Dendritické signály
Kdyby neurony nekompenzovaly úbytky napětí během přenosu signálu, nedostávaly by hlášení ze svých nejvzdálenějších vstupů. Zhruba 1011–1012 neuronů v našem mozku slouží jako převodníky vstupních signálů na výstupní. Krmení každého neuronu informacemi závisí na stromovitě rozvětvené síti dendritů – krátkých výběžků vyrůstajících z těla neuronu a přijímajících vstupní informaci. Je jich větší počet, bohatě se větví a na povrchu mívají dendritické trny, v nichž se stýkají s výběžky jiných neuronů – vytvářejí synapse (kontaktní místa, kde jsou membrány neuronů odděleny štěrbinou širokou 30–40 nm; viz také obrázky ve Vesmíru 79, 375, 2000/7). Kmen každého dendritického stromu vyrůstá z těl jednotlivých neuronů (somat). Z těla neuronu vychází také axon, dlouhý výběžek, jenž přenáší informaci k dalším vzrušivým buňkám a jehož morfologické a funkční vlastnosti se od vlastností dendritu liší.
Vše, nebo nic
Dendritická zakončení mohou sahat poměrně daleko. Bývají až milimetr dlouhá a dendritický strom, jenž má původ v jediném neuronu, může propojovat až 10 000 dalších buněk. Vstupy z dendritů jsou vyhodnocovány na neuronálním těle. Samotné tělo neuronu zanechává tato aritmetika stimulujících a tlumivých signálů vcelku klidným. Na výsledný integrovaný signál však reaguje počáteční úsek axonu, který je pro neuron vlastním výstupním kabelem. Tato oblast axonu se nazývá iniciální segment a oproti dendritům je elektricky velmi citlivá. Je hustě vybavena nízkoprahovými sodíkovými kanály řízenými napětím (viz např. Vesmír 72, 316, 1993/4, Vesmír 79, 312, 2000/6). Podle toho, jestli v daný okamžik integrovaný signál z dendritů překročí, nebo nepřekročí práh k jejich otevření, buď vznikne, nebo nevznikne nový akční potenciál (proto se tomuto typu signálu říká odpověď „vše, nebo nic“). Ten se po axonu rozběhne již jako průběžně zesilovaný a konstantně velký informační bit směřující buď k jiným neuronům, nebo daleko do periferie k výkonným orgánům, jako jsou svaly, žlázy aj.Z tvaru dendritického stromu je zřejmé, že některé dendrity leží od těla neuronu dále než jiné. Kdyby signál během šíření neslábl, nehrála by vzdálenost dendritu od těla neuronu žádnou roli. Dendrity postrádají izolační vrstvu myelinu, 1) která by ztráty při přenosu vzruchu snižovala.
Při vedení elektrického signálu se proto chovají jako vodiče poněkud „děravé“, a kdyby vzdálenější dendrity neuměly své signály zesílit, jejich elektrické volání by zaniklo v hluku elektrických výkřiků těch jejich šťastnějších bratránků, kteří se vyskytují blíže neuronálního těla.
Buď tedy vznikl systém s neefektivní složkou, nebo existuje způsob jak signály zesílit. Správná možnost je ta druhá. Jeff Magee z Louisianské státní univerzity a Erik Cook z Baylorovy lékařské fakulty prokázali, že signály doputují k tělu neuronu stejně silné bez ohledu na to, jak daleko v dendritickém stromu vzniknou. Není to tím, že by cestou k neuronálnímu tělu byly udržovány na stejné intenzitě, ale tím, že jejich počáteční velikost je přímo úměrná vzdálenosti místa vzniku od somatu.
Počátek šíření signálu
Signály putující vzrušivými buňkami lze považovat za časovou změnu transmembránového napětí. Napěťové změny jsou důsledkem otevírání a zavírání membránových kanálů pro některé ionty, zejména pro ionty sodné a draselné. Pokud neuron nesignalizuje, specializované membránové transportní proteiny (Na+/K+ ATPáza a jiné) udržují iontový status quo: vyšší koncentraci iontů draslíku a nižší koncentraci iontů sodíku uvnitř buňky oproti prostředí mimo buňku. Výsledkem je klidový membránový potenciál (rozdíl napětí mezi vnitřkem a vnějškem buňky) okolo –70 mV.Aby mohl neuron vyslat signál, musí tento status quo porušit. Nejdřív se depolarizuje membrána a otevřou se iontové kanály pro sodné ionty, které jsou poháněny koncentračním gradientem a taženy ve směru svého rovnovážného potenciálu do nitra buňky. To vyvolá další snížení membránového potenciálu a způsobí, že se otevírají další a další napěťově závislé sodíkové kanály. Na+ ionty vtékají do buňky a membránový potenciál roste směrem ke kladným hodnotám. Sodíkové kanály se otevírají na dobu necelé jedné milisekundy, potom jsou už na depolarizaci necitlivé. Znovu se mohou otevřít až poté, kdy se opět ustaví původní klidový membránový potenciál.
Po iontech sodíku vstupují s určitým zpožděním do hry ionty draselné. Otevírají se napěťově závislé draslíkové kanály, ionty K+ vytékají z buňky a membránový potenciál se vrací k své klidové hodnotě. Draslíkové kanály zůstávají – na rozdíl od Na+ kanálů – otevřeny po celou dobu depolarizace, a to i po uzavření kanálů sodíkových. Mohutný vtok iontů K+ do buňky způsobí hyperpolarizaci, která je (spolu s limitovanou dobou otevření sodíkových kanálů) zárukou, že se signály šíří pouze jedním směrem. Membrána neuronu je v místech, kudy právě proběhl akční potenciál, po určitou dobu na další depolarizaci necitlivá. Představme si řadu kostiček domina: Vlna, která bortí pracně poskládaný obrazec, už po spadaných kostkách nepoběží zpět. Oproti zbořeným kostkám domina ovšem neuronální membrána může uvést postavení svých iontových kanálů do funkčního stavu, v němž byly před průchodem vlny akčního potenciálu.
- Aktivní impulzy. Obousměrný pohyb iontů přes membránu se neděje po celé délce nervového vlákna najednou, toky iontů se šíří v podobě samonosných pulzů – akčních potenciálů. Tyto aktivní impulzy se mohou šířit na značné vzdálenosti. Nejdelší axony v lidském organizmu jsou až metr dlouhé.
- Pasivní šíření signálu. Iontové kanály se na jednom konci neuronu otevřou a ionty jimi protékající představují určité kvantum náboje, které se šíří dál neuronem na základě coulombické repulze (vzájemného odpuzování iontů o stejném náboji). Šíření tohoto signálu není podpořeno aktivně, tj. tokem iontů přes napěťově řízené iontové kanály, neboť změna transmembránového napětí není nikdy tak vysoká, aby dosáhla prahu pro jejich otevření. Pasivní šíření signálu hraje hlavní roli v dendritech. Signály, které vznikají na dendritech a s úbytkem amplitudy se šíří k tělu neuronu, se jmenují postsynaptické potenciály. Mohou být dvojí: exitační (depolarizující membránu) nebo inhibiční.
Metoda terčíkového zámku
Základní principy stojící na pozadí aktivní propagace (šíření) signálu formulovali ve čtyřicátých letech angličtí fyziologové Alan Hodgkin a Andrew Huxley (nositelé Nobelovy ceny z r. 1963), kteří experimentovali s obřími axony sépie majícími až 1 mm v průměru. Do tak velkých axonů se dají zavést tenké kovové elektrody pro snímání elektrických potenciálů a proudů tekoucích přes membránu.Studium šíření signálů v dendritech je náročnější, neboť průměr typického dendritu v savčím mozku je několik mikrometrů. J. C. Magee a E. P. Cook k svým pokusům využili techniku terčíkového zámku, kterou v sedmdesátých letech vyvinuli Erwin Neher a Bert Sakman. Podstatou techniky je přisátí skleněné mikropipety s vodivým roztokem o průměru špičky okolo 1 m na maličký okrsek (terčík) buněčné membrány. Aplikací podtlaku (např. nasátím) se okraje terčíku těsně spojí s čistými a otavenými okraji mikropipety. Tím se terčík elektricky izoluje od zbytku membrány, a proto můžeme měřit proudy tekoucí pouze několika, či dokonce jedním iontovým kanálem, který se vyskytuje na tomto kousku membrány. Dále máme několik možností:
- Můžeme aplikovat ještě větší podtlak, terčík protrhnout a měřit toky proudů stovkami kanálů na povrchu buňky.
- Terčík vymezený okraji mikropipety můžeme odtrhnout, pak je intracelulární strana membrány vystavena roztoku o zvoleném složení.
- Po protržení buňky můžeme pipetu opatrně odtáhnout. Membrána se při tom zaškrtí a po odtržení je terčík orientován svou původně extracelulární stranou do roztoku.
- Poslední variantou je včlenění látek imitujících iontové kanály (nystatin, amfoterecin B, gramicidin) z roztoku v pipetce do terčíku. Terčíkem pak mohou téci ionty, ale zároveň je zabráněno úniku intracelulárních částic o molekulové hmotnosti větší než 100.
Synaptické stupňování
Vraťme se k pokusům Mageeho a Cooka. Jako experimentální model si vybrali CA1 oblast hipokampu, která je zřejmě jedním z center učení a paměti. Hipokampus je párový útvar na spodní části předního mozku savců, zapojený nejen do procesů paměti, ale i do limbického systému řídícího naše emoce a nálady. Pacienti s poškozeným hipokampem si pamatují jen události před poškozením, operací nebo úrazem.Hipokampus lze z mozku snadno izolovat. Tvarem vzdáleně připomíná mořského koníka (odtud i jeho název) a strukturou makový závin s několika vrstvami buněk (máku) a spojovacího těsta – neuronálních výběžků. Nejen při krájení závinu, ale i při krájení hipokampu lze postupovat tak, abychom „maková zrnka“ nepoškodili. Asi půlmilimetrové řezy hipokampu si zachovávají příčnou strukturu a propojení několika vrstev neporušených neuronů.
Proč J. Magee a E. Cook v hipokampu zvolili právě neurony z oblasti CA1? Na těch jejich dendritech, které vytvářejí stejnou vstupní dráhu k somatu, se dají měřit signály až do vzdálenosti 500 m.
Ke sběru dat použili systém tří mikropipetek. První registrační pipetka byla v konfiguraci „snímání z celé buňky“ umístěna na těle neuronu, druhá v dendritických větvích. Tou byla měřena síla impulzů v různé vzdálenosti od těla neuronu. Třetí pipetku použili Magee a Cook ke vstřikování nepatrných kapek hustého cukerného roztoku o vysokém osmotickém tlaku na synapse dendritů.
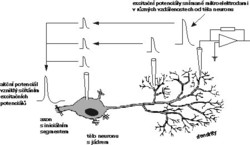 Užití dvou mikropipet k simultánnímu nahrávání signálu není nové. Současné užití třetí elektrody k aplikaci vysokoosmotického roztoku je ovšem chytrý trik. Osmoticky se synapse povzbudí k zvýšené činnosti, a přitom se nepodráždí jiné struktury v okolí.
Užití dvou mikropipet k simultánnímu nahrávání signálu není nové. Současné užití třetí elektrody k aplikaci vysokoosmotického roztoku je ovšem chytrý trik. Osmoticky se synapse povzbudí k zvýšené činnosti, a přitom se nepodráždí jiné struktury v okolí.
Magee a Cook zjistili, že nezáleží na tom, kde signály vznikají: záznamy signálů na těle neuronu byly přibližně stejně velké, ať přicházely ze vzdálených nebo z blízkých dendritů. Jak je to možné, když během šíření po dendritech slábnou?
Až dosud si vědci mysleli, že by signály mohly být přece jen nějak zesilovány během své cesty dendritickým stromem – buď otevíráním dalších iontových kanálů, nebo na základě geometrie dendritického stromu. Rozložení odporu by mohlo pasivně kompenzovat ztráty signálu během cesty k somatu. Magee a Cook ale ukázali, že signál je zesílen přímo na synapsi, a to tím více, čím je synapse vzdálenější. Tento jev nazvali synaptické stupňování. Ze záznamů v místě vzniku bylo jasné, že impulzy o největší amplitudě vznikaly na nejvzdálenějších dendritických synapsích (obrázek), což umožní, aby váha dendritických synapsí (jejich podíl na vypracování odpovědi „vše, nebo nic“) na iniciálním segmentu axonu byla téměř stejná.
Volání nazpět
Jak dendritická synapse „pozná“ svou vzdálenost od těla neuronu? Roku 1994 Greg Stuart a Bert Sakmann zjistili, že se akční potenciály mohou v hipokampálních neuronech šířit i zpětně, z iniciálního segmentu axonu přes soma neuronu zpět do dendritů. Roku 1997 Dax Hoffman se spolupracovníky objevil, že dendrity hipokampálních neuronů jsou velmi hustě posety draslíkovými kanály typu A. Tento typ kanálu K+ je v klidu otevřený a zřejmě se účastní aktivního i pasivního šíření impulzu.K čemu je dendritům, které jsou samy o sobě velmi špatnými vodiči, takové množství iontových kanálů? Magee a Cook zjistili, že typ A kanálů K+ je „vypínán“ (vyřazován z provozu) excitačními postsynaptickými potenciály. Tím, že jsou tyto kanály umlčeny, vzroste izolační schopnost membrány a uvolní se cesta zpětně se šířícím akčním potenciálům putujícím od těla neuronu na synapsi. Pokud zpětně putující akční potenciály dorazí až k synapsi, mohou tam způsobit dlouhotrvající vzrůst citlivosti ke vstupním signálům. Citlivost vzdálenější synapse je zesílena, pokud jsou excitační postsynaptické potenciály, které „vypnou“ typ A draslíkového kanálu, schopny vyvolat zpětně se šířící akční potenciál ještě předtím, než se kanály znovu otevřou.
Opakování matkou moudrosti
Dlouhodobé posilování komunikace na synapsi častým a opakovaným používáním považoval za základ procesů učení a paměti už Donald Hebb roku 1949. Tento předpoklad formuloval mnoho desítek let předtím, než byly známy klíčové detaily neurofyziologie. O 34 let později pozorovali týž jev na buněčné úrovni Terje Lømo a Timothy Bliss. Pojmenovali jej dlouhodobá potenciace. Zda je dlouhodobá potenciace opravdu podkladem učení a paměti, zůstává předmětem intenzivního výzkumu, vášnivých debat a protichůdných námitek. Výsledky pokusů na zvířatech, jejichž dlouhodobá potenciace byla farmaky posílena, či naopak oslabena, jsou rovněž nejednoznačné, byť mnoho vědců zastává názor, že dlouhodobá potenciace, proces učení a tvorba paměťové stopy spolu souvisejí.Molekulární mechanizmus dlouhodobé potenciace byl vysvětlován několika způsoby. Jeden čas převládala domněnka, že se na dráždění a dlouhodobé potenciaci účastní oxid dusnatý, který vzniká v postsynaptickém neuronu, difunduje do presynaptického nervového zakončení a fosforylací proteinů nutných pro výlev neuropřenašeče zvětšuje jeho množství. Při dlouhodobé potenciaci však bylo pozorováno i zvýšení počtu AMPA-glutamátových receptorů, čímž vzrůstá postsynaptická citlivost i velikost synaptických proudů.
 Na molekulární úrovni se dlouhodobá potenciace a synaptické stupňování projevují podobně. Rozdíl je pouze v tom, zda jsou patrné změny na presynaptické (axonální), nebo na postsynaptické (dendritické) straně synapse. Většina nervových kontaktů (synapsí) nepropojuje buňky přímo. Presynaptická a postsynaptická membrána jsou odděleny synaptickou štěrbinou. Aby se signál přes tuto štěrbinu přenesl, vyšle presynaptické zakončení jeden či více „balíčků“ molekul – neuropřenašečů. Když se signální molekuly přepraví přes štěrbinu, navážou se na receptory – speciální iontové kanály – jejichž otevírání je kontrolováno právě navázáním neuropřenašeče. Kanály po otevření vpouštějí do buňky nebo z ní sodné, draselné, chloridové či vápenaté ionty, takže se mění transmembránový potenciál a mohou vznikat excitační, nebo inhibiční synaptické proudy.
Na molekulární úrovni se dlouhodobá potenciace a synaptické stupňování projevují podobně. Rozdíl je pouze v tom, zda jsou patrné změny na presynaptické (axonální), nebo na postsynaptické (dendritické) straně synapse. Většina nervových kontaktů (synapsí) nepropojuje buňky přímo. Presynaptická a postsynaptická membrána jsou odděleny synaptickou štěrbinou. Aby se signál přes tuto štěrbinu přenesl, vyšle presynaptické zakončení jeden či více „balíčků“ molekul – neuropřenašečů. Když se signální molekuly přepraví přes štěrbinu, navážou se na receptory – speciální iontové kanály – jejichž otevírání je kontrolováno právě navázáním neuropřenašeče. Kanály po otevření vpouštějí do buňky nebo z ní sodné, draselné, chloridové či vápenaté ionty, takže se mění transmembránový potenciál a mohou vznikat excitační, nebo inhibiční synaptické proudy.
Zesílení vstupního signálu rovnou na synapsi ve vzdálených oblastech dendritického stromu – synaptické stupňování – by podle J. Mageeho mohlo být způsobeno výlevem většího počtu kvant na jeden synaptický podnět. Jedním z dalších faktorů by mohl být větší počet receptorů na vzdálenějších synapsích. Jaké změny na synaptické membráně způsobuje zpětné šíření akčních potenciálů, to se zatím přesně neví.
Nová proměnná v Hebbově modelu
Ať už je podkladem synaptického stupňování na dendritech cokoliv, zavádí tento objev novou proměnnou do Hebbova modelu učení a paměti. Podle Hebbovy hypotézy, že komunikace na synapsi je posilována dlouhodobě, by důležitost synapse v neuronální síti určovala její historie (tj. to, jaké děje a jak často na ní probíhaly). Jestliže vezmeme v úvahu proces synaptického stupňování, bude změna úlohy synapse v procesu učení určována také polohou v dendritickém stromu.Literatura
Hoffman D. A. a spol.: Nature 387, 869–875, 1997Magee J. C., Cook E. P.: Nat. Neurosci. 3, 895–903, 2000
Smith C. U. M.: Elements of Molecular Neurobiology, Wiley and Sons Ltd. 1997, England
Poznámky
Ke stažení
 Článek ve formátu PDF [182,66 kB]
Článek ve formátu PDF [182,66 kB]

























