Podíl infekce na vzniku a rozvoji aterosklerózy
Orgánové komplikace aterosklerózy – ischemická choroba srdeční, mozkové cévní příhody a ischemická choroba dolních končetin – jsou převažující příčinou úmrtí v civilizovaných zemích. V České republice zemřelo v roce 1993 na kardiovaskulární onemocnění včetně cévních onemocnění mozku celkem 65 986 osob, tj. 55,8 % všech zemřelých. Právě předčasné projevy aterosklerózy orgánovými komplikacemi již ve středním věku byly typické nejen pro bývalé Československo, ale pro většinu zemí bývalého komunistického bloku, z ostatních evropských zemí pak pro Finsko a Skotsko. Ateroskleróza byla vždy považována především za onemocnění metabolického původu (viz také Vesmír 70, 30, 1991/1).
Stadiu poškození cévní stěny předchází zvýšená expozice chemickým či biologickým patogenům (viz tab. I.). Prvním stadiem poškození tepenné stěny je porucha funkce endotelových buněk vystýlajících její vnitřní povrch, která vyústí v jejich poškození. V tomto stadiu se zhorší možnost rozšířit průsvit tepny (relaxace) a zvýší přilnavost okrajů endotelových buněk. Důsledkem tohoto jevu je sklon k stažení tepen, k tvorbě destičkové krevní sraženiny (trombu) a konečně k proniknutí zánětlivých buněk do cévní stěny. K počátečnímu poškození endotelu přispívá z chemických faktorů zejména vyšší hladina lipoproteinů o nízké hustotě (LDL). Nebezpečnější jsou glykované LDL u diabetiků. Z dalších faktorů pak poškození endotelu působí vyšší hladina homocysteinu, tabákový kouř, nedostatek kyslíku v organizmu, cytostatika a ionizující záření. K poškození přispívá rovněž vysoký krevní tlak, turbulentní proudění v tepnách, infiltrace endotelu imunokomplexy a poruchy vzniklé nadměrným hromaděním organických látek (tezaurismózy).
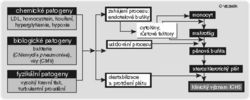
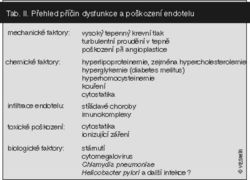
Z biologických faktorů může postihovat endotel zejména cytomegaloviróza a snad i některé bakteriální infekce. K poruše funkce a poškození endotelu dochází více se stoupajícím věkem. Dalšími příčinami bývají mechanické poškození endotelu po léčebné angioplastice a zvýšená regenerace endotelu po obnovení průtoku v původně uzavřené tepně. 
Endotel významně ovlivňuje napětí cévní stěny uvolňováním různých působků. Funkčně nepoškozený endotel tepen produkuje jak oxid dusnatý (viz Vesmír 72, 255, 1993/5), který tepny rozšiřuje, tak endotelin 1, který má stahující účinek. Poškozený endotel však produkuje méně oxidu dusnatého a více endotelinu1. Proto se malé tepny více stahují a zvýšuje se jejich napětí. Následkem toho dochází ke zvýšení krevního tlaku. K důsledkům poruchy funkce endotelu patří též snížená produkce látky urychlující vznik tkáňového plazminogenu (TPA) a zvýšená produkce látky zpomalující vznik plazminogenového aktivátoru (PAI – 1), což vede k větší pohotovosti tvořit krevní sraženiny, a dále produkce řady cytokinů a přilnavých molekul.
Většina lipidů, které jsou v aterosklerotických lézích (tj. poškozených místech), pochází z plazmatických LDL částic, které vstupují do cévy přes poškozený či nefunkční endotel (I)1. Všechny buněčné typy cévní stěny a také buněčné typy aterosklerotické léze mohou oxidovat LDL (II). V endotelových buňkách vznikají mírně oxidované LDL, které mohou hrát spouštěcí roli při vtahování monocytů do cévní stěny tím, že indukují expresi adhezivních glykoproteinů na buněčném povrchu endotelových buněk. Po přilnutí monocytů na endotelie jiné specifické molekuly produkované endotelovými buňkami (monocytární chemotaktický protein 1 a faktor stimulující kolonie) přitahují monocyty do prostoru těsně pod vrstvou endotelu. Vstup zánětlivých buněk do cévní stěny je tedy vícestupňový proces, zahrnující postupné interakce mezi adhezivními (přilnavými) molekulami ze skupiny selektinu, chemokinu, adhezivními molekulami ze skupiny integrinu, chemoatraktanty a cytokiny (viz tab. III).
Poté, co monocyty vstoupily do cévní stěny, jsou diferencovány na makrofágy (IV). V makrofázích dochází k přeměně mírně oxidovaných LDL na vysoce oxidované LDL. Ty se vážou na zvláštní, tzv. scavangerový receptor makrofágů, do makrofágů vstupují a postupně je mění na pěnové buňky. Myšlenka, že oxidace lipidů přispívá aterogenezi, pochází již z počátku 80. let našeho století. Oxidace lipidů je prokazatelná ve všech stadiích aterosklerózy, zvláště v raných a makrofágy bohatých aterosklerotických poškozeních. Přítomnost velkého množství pěnových buněk v pokročilé aterosklerotické lézi může být považována za ukazatel rozvoje aterosklerózy. Makrofágy i pěnové buňky mohou po nasycení tuky i po svém zániku uvolnit velké množství oxidovaného, esterifikovaného a volného cholesterolu a tím dále ničit endotel (V) a podílet se na dalším rozvoji aterosklerotického poškození. V časném poškození se nacházejí estery cholesterolu v olejnato-krystalické fázi, při pozdním se tvoří tuhé krystaly cholesterol-monohydrátu (viz obr. obrázek). 
Lipoproteiny o vysoké hustotě – HDL mohou chránit LDL před oxidací či následnými kroky a mohou chránit i před nadměrnou akumulací tuku v cévní stěně. HDL přispívají významně k zpětnému transportu cholesterolu z cévní stěny (viz obr. obrázek – VI).
Cytokiny a růstové faktory uvolňované z endotelových buněk, makrofágů, pěnových buněk a trombocytů přilepených na poškozené endotelové buňky způsobují chaotický růst svaloviny stěny tepny. Kromě toho některé buňky hladké svaloviny tepny putují do prostoru těsně pod endotelovými buňkami. Protože fibroblasty jsou rovněž stimulovány růstovými faktory, dochází k větší tvorbě a hromadění kolagenu v mezibuněčném prostoru. Výsledkem těchto změn (chaotický růst svaloviny tepenné stěny, hromadění lipidů v pěnových buňkách, později i v buňkách hladkého svalstva a endotelu, obsah krystalů cholesterolu a větší obsah kolagenních vláken v tepenné stěně ) je tuhá, nepružná, zúžená tepna.
Vlastní aterosklerotický plát je složen především z pěnových buněk, makrofágů, mezibuněčně uložených LDL, krystalů cholesterolu a kolagenních vláken. Na periferii aterosklerotického poškození se nacházejí další buňky typické pro zánět: lymfocyty a plazmocyty. Celá léze je potažena tenkým vazivovým krytem. Integrita plátu a jeho vazivového krytu je zásadním faktorem jeho stability. Infarkt myokardu je většinou výsledkem trhliny nebo praskliny malého ateromatózního plátu koronární tepny. 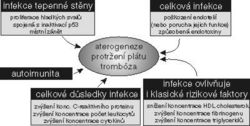
Uzávěr koronární tepny, který bezprostředně vede k infarktu myokardu, je pravděpodobně výsledkem praskliny plátu v jeho měkké, na makrofágy bohaté části. Na rozrušení mimobuněčné základní hmoty a následném protržení plátu se významně podílejí enzymy metaloproteinázy, které byly více přítomny u makrofágů nemocných nestabilní anginou pectoris2. To dále ukazuje na možnou až pravděpodobnou aktivní roli makrofágů při prasknutí plátu.
Na to, že přestálá infekce může aterosklerotické změny urychlit, upozornili již B. Bednář a R. Vaněček v učebnici patologie z r. 1964. V posledních letech se diskutuje především o cytomegalové infekci a infekci způsobené bakterií Chlamydia pneumoniae. Tak například byla Chlamydia pneumoniae izolována ze 79 % všech vzorků získaných z koronárních tepen postižených aterosklerotickým procesem. U pacientů s recidivou zúžení koronární tepny byla i po zprůchodnění tepny balonkem předchozí infekce cytomegalovým virem (CMV) silným nezávislým rizikovým faktorem této recidivy. O tomto viru je známo, že zprostředkovává expresi produktů mnoha buněčných genů podílejících se na zánětlivé a imunitní odpovědi. Cytomegalovirus bývá přítomen v hladkých svalech zúžené tepny a může vést k expresi bezprostředních genových produktů, které inhibují funkci p53, a tak přivodit zhoršení apoptózy buněk tepenné výstelky (o apoptóze viz např. Vesmír 73, 550 a 552, 1994/10). Infekční postižení hladkých svalů tepny cytomegalovirem vede k expresi a sekreci růstových faktorů. Cytomegalovirus také zvyšuje přilnutí leukocytů a destiček na endotelové buňky indukcí buněčné exprese adhezivních molekul a způsobuje změny, které podporují srážení krve. Navíc pod vlivem cytomegaloviru vznikají bílkovinné produkty IE72 a IE84, které rovněž brání apoptóze, což může vést k nadměrnému hromadění buněk výstelky tepen. Cytomegalovirová infekce též v jednom sledování souvisela s výskytem vysokého krevního tlaku. Je jen logické, že u nemocných nestabilní anginou pectoris byly oproti nemocným se stabilní formou této choroby nalezeny zvýšené hladiny C-reaktivního proteinu, hlavního proteinu akutní fáze, který je zvýšený zvláště u infekčních nemocí. Infekce navíc ovlivňuje klasické rizikové faktory aterosklerózy: vede k poklesu HDL cholesterolu a vzestupu plazmatického fibrinogenu a triacylglycerolů. Infekční faktory se mohou podílet i na aktivaci autoimunitního procesu, který rovněž může zasáhnout do rozvoje aterosklerózy. Přehled vztahů mezi infekcí a aterosklerózou je na obrázku č. obrázekU těch nemocných, kde C-reaktivní protein (CRP) zůstává měsíce zvýšený, je značné riziko nestability anginy pectoris či rozvoje akutního infarktu myokardu. C-reaktivní protein produkují játra, cytokin odpovědný za jeho produkci je interleukin 6. Ten spolu se svým hlavním spouštěčem faktorem nekrotizujícím nádory – TNF (podrobněji o TNF viz Vesmír 70, 386, 1991/7) mají vlastnosti, které podporují rozvoj zánětu a srážení krve. Tyto cytokiny mohou aktivovat endotel k produkci látek stahujících tepny a tvorbě adhezivních receptorů pro leukocyty.
V procesu vyzrávání, migrace a množení buněk, které se účastní aterosklerotického procesu, hrají totiž cytokiny a růstové faktory zásadní roli. Termín cytokin byl původně rezervován pro přenašeče imunitních dějů a zánětů, zatímco růstové faktory řídily proliferaci a chemotaxi tkáňových buněk. V procesu aterogeneze jsou však tyto děje natolik provázány, že nelze jednoznačně říci, který z následujících faktorů je vysloveně cytokin a který růstový faktor.
Cytokiny, jako jsou interleukin 1, interleukin 2, faktor nekrotizující nádory, interferon a faktory stimulující růst kolonií, jsou modulátory zánětlivé reakce, která nastává při poškození endotelových buněk. Růstové faktory zahrnující destičkový růstový faktor, bazický fibroblastový růstový faktor, inzulinu podobný růstový faktor, interleukin 1, TNF a faktor transformující růst mohou všechny spustit pomnožení buněk hladké svaloviny tepny a některé z nich pak mohou působit jako chemoatraktanty, přitahující leukocyty do tepenné stěny či buňky hladké svaloviny ze střední vrstvy (medie) do vnitřní (intimy). Faktory stimulující růst kolonií (CSF), monocytový chemotaktický protein 1, faktor transformující růst, ale i např. oxidované LDL způsobují chemotaxi monocytů a přestavbu endotelu. Tyto molekuly se vyskytují pouze v místech poškozených aterosklerózou a ve stěně nepoškozené tepny nebývají nalézány. Poznání a vyhodnocení funkcí těchto řídících molekul poskytuje možnost k terapeutickému zásahu. Dnes je již například známo, že syntézu TNF lze zabrzdit podáním pentoxyfilinu, léku, který se při léčbě cév používá již desetiletí pro lepší proudění krve. 
V posledních 2–3 letech se zjistily zvýšené hladiny CRP u pacientů s chronickou infekcí dýchacích cest způsobenou Chlamydia pneumoniae a u nemocných s chronickou gastritidou způsobenou Helicobacter pylori. U nemocných těmito chorobami a u pacientů trpících chronickou zubní infekcí byly prokázány vztahy k ischemické chorobě srdeční. Je však nutné se zmínit o tom, že jistě ne všechny případy akutních forem ischemické choroby srdeční jsou spojeny s akutní zánětlivou odpovědí. Asi u čtvrtiny pacientů nebyl nalezen zvýšený CRP. Podíl infekčních činitelů na nestabilitě plátu by mohl také vysvětlit neexistenci přímého vztahu mezi rozsahem aterosklerotického procesu a klinickými příznaky ischemické choroby srdeční. Celkově je dobře možné předpokládat, že zatímco utváření aterosklerotického plátu je chemicky indukováno především částicemi LDL, jeho nestabilita může být výrazně ovlivněna infekčními (a také chemickými) faktory.
Nedávné studie prokázaly, že nejčastější příčinou akutního infarktu myokardu a dalších akutních koronárních syndromů jsou mírně až středně velké aterosklerotické léze, vyznačující se velkým obsahem tuku uloženým mimobuněčně ve středu plátu, který je pokryt tenkým vazivovým krytem. Tyto pláty obsahují jen malé množství vazivové mezibuněčné hmoty, proto mohou snadno podlehnout pasivnímu roztržení. Krom toho bývá plát destabilizován aktivně, což je jev, který souvisí s aktivitou makrofágů a pěnových buněk. K destabilizaci plátu zřetelně přispívají chemické a biologické faktory, především oxidované LDL a pravděpodobně také infekce. Rýsuje se řada terapeutických přístupů, které vyplývají z porozumění vzniku a vývoji procesu aterosklerózy. Základním preventivním ale i léčebným opatřením zůstává ovlivnění životosprávy: dieta, zákaz kouření a tělesný pohyb. Množství prostředků použitelných k ovlivnění rizikových faktorů aterosklerózy se výrazně zvýšilo. K nejdůležitějším terapeutickým možnostem patří podávání statinů, léků, které přímo blokují syntézu cholesterolu, ale také pravděpodobně částečně upravují porušenou funkci endotelových buněk. Z dalších možností se nabízí podávání antioxidačně působících látek, zejména α tokoferolu. Léčení vysokého krevního tlaku látkami brzdícími enzym konvertující angiotenzin (ACE) má ochranný účinek i na endotel, na neutrofily a monocyty, dále pak zpomaluje růst hladkého svalstva tepen, brání aktivaci trombocytů a podporuje endogenní rozpouštění trombu. Inhibitory ACE působí také jako ochrana před prasknutím plátu. Je možné, že kyselina acetylsalicylová, podávaná původně s cílem ovlivnit trombocytární funkci, působí i na zánětlivý proces v cévní stěně. Podávání nitrátů vede k ovlivnění cévního napětí a patrně blokuje i účinky některých cytokinů na proliferaci hladkých svalů tepen. Z výsledků nálezů infekčních faktorů u nemocných koronární sklerózou vyplývá, že je nutno důsledně léčit všechny infekce, zejména bronchiální, zubní a také infekce žaludeční sliznice, způsobené Helicobacter pylori. V literatuře se objevily první zprávy o možném léčebném účinku antibiotika Roxitromycin v léčbě nestabilní anginy pectoris.
Znalosti o tom, že ateroskleróza je vlastně pomalu probíhající chronický zánět s aspekty střídavého procesu, mají tedy významné důsledky léčebné. Je pravděpodobné, že léčba acetylsalicylovou kyselinou nepůsobí jen na shlukování krevních destiček, ale i na zánětlivý proces v cévní stěně. Je možné, že se dočkáme rutinního podávání antibiotik v některých stadiích aterosklerotického procesu. Možnost očkování proti některým infekčním faktorům (chlamydie, helicobacter či cytomegalovirus) se dnes zdá ještě fantazií. Zítra by mohla být realitou.
Chlamydie jsou malé bakterie, které byly dříve považovány za viry. Do tohoto rodu patří kromě Chlamydia pneumoniae ještě Chlamydie trachomatis, která vyvolává oční onemocnění trachom, popřípadě zánět močových cest, prostaty, nadvarlete apod. Další zástupce
SLOVNÍČEK
cytokiny
Ke stažení
 Článek ve formátu PDF [980,58 kB]
Článek ve formátu PDF [980,58 kB]