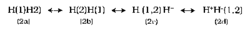Poznámky k dílu Linuse Paulinga
| 5. 1. 1995Nedávno zesnulý Linus Pauling je příkladem velmi všestranného badatele, který měl vzácný dar postřehnout podstatné rysy problémů, jež řešil. Mohl tedy pro daný problém méně důležité rysy zjednodušit nebo zcela zanedbat a tímto způsobem dospět k užitečnému a často i velmi názornému popisu studovaného jevu. Nemohu zde líčit jeho mimořádně významné zásluhy pro rozvoj nejrůznějších přírodnich věd. Jeho průkopnický objev helixového modelu proteinů byl oceněn např. udělením Nobelovy ceny r. 1954. Omezím se v této úvaze pouze na jeden velmi charakteristický a zajímavý aspekt jeho pojetí chemické vazby, které má klíčový význam v přibližné kvantové chemické metodě valenční vazby. Tento rys se týká zobrazení skutečnosti pomocí znaků a hodnoty takto získaných výpovědí v této řeči pro pochopení zakonitostí vnějšího světa. Domnívám se, že semiotické aspekty Paulingova přístupu k chemickým jevům jsou velmi poučné i pro aktuální diskusi o hodnocení přírodních věd. I když Paulingův popis povahy chemické vazby v aromatických uhlovodících je zvláště názorný a originální (viz např. článek R. Zahradníka), je poučné volit jako názorné příklady jeho pojetí chemické vazby nejjednodušší chemické systémy H2+ a H2. V Paulingově řeči je připisována stabilita H2 současné platnosti a vzájemné interakci (rezonanci) chemicky snadno pochopitelných struktur H+ H aH H+. To znamená, že jediný elektron, označený symbolem (1), je současně u vodíkového atomu nalevo a u vodíkového atomu napravo. Tento předpoklad popisuje rezonanční formule: 
Kvantověchemický přepis rezonanční formule říká už více, neboť vystihuje stav elektronu jako superpozici stavu elektronu lokalizovaného u levého a upravého atomu v rámci zákonů kvantové teorie. V kvantověchemickém nářečí se to vyjadřuje jako superpozice atomových orbitů (stavů) vodíkového atomu nalevo s1(1) a pravého vodíkového atomu sp(1):
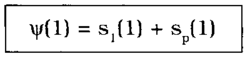 Superpozice Ψ atomovych orbitů s1 a sp se nazývá molekulární orbit. I z tohoto elementárního popisu vyplývá, díky kvantověmechanickým zákonitostem, stabilita sloučeniny H2+. Samozřejmě že přítomnost pozitivního náboje H+ způsobuje polarizaci stavu elektronu lokalizovaného u druhého partnera H. Ale tento efekt sám nevysvětluje stabilitu H2+ a může tudíž být vprvém, nejhrubším přiblížení zanedbán. Polarizační efekt je ale důležitý a je proto nutné jej uvažovat při kvalitnějších výpočtech. Ale to podstatné je vystiženo i nejjednodušším rezonančním popisem. Podobně je možno popsat stav dvou elektronů v molekule H2 rezonanční formulí
Superpozice Ψ atomovych orbitů s1 a sp se nazývá molekulární orbit. I z tohoto elementárního popisu vyplývá, díky kvantověmechanickým zákonitostem, stabilita sloučeniny H2+. Samozřejmě že přítomnost pozitivního náboje H+ způsobuje polarizaci stavu elektronu lokalizovaného u druhého partnera H. Ale tento efekt sám nevysvětluje stabilitu H2+ a může tudíž být vprvém, nejhrubším přiblížení zanedbán. Polarizační efekt je ale důležitý a je proto nutné jej uvažovat při kvalitnějších výpočtech. Ale to podstatné je vystiženo i nejjednodušším rezonančním popisem. Podobně je možno popsat stav dvou elektronů v molekule H2 rezonanční formulí 
A zase již tento popis podle Heitlera a Londona vystihuje některé rysy systému H2, např. jeho stabilitu. Rozšířením rezonance o polární struktury (2c) a (2d) zlepšuje dále kvantověchemický popis molekuly H2.
Myšlenkově obdobný je proslulý popis aromatické vazby v benzenu (viz obr. 1)
Také v případě rezonačních popisů sloučeniny C6H6 je možno přiřadit rezonančním vzorcům kvantověchemické veličiny (např. vlnové funkce) a vyvodit z nich podle zákonů kvantové mechaniky výpovědi o meřitelných vlastnostech. Bohužel, lidé jsou už od pravěku zatíženi mánií vysvětlit zákony vnějšího světa - a to nejen neživé přírody, ale také lidské společnosti - domněnkou, že skutečná skutečnost je vlastně cosi, co je v pozadí za zdánlivou skutečností. Proto také Paulingův způsob uvažování rozzuřoval pravověrné marxisty-leninisty k nepříčetnosti. Benzen musí být podle nich jedna chemická formule a ne dvě či více současně. Samozřejmě že benzen není ani Paulingova rezonanční formulace vazebných poměrů v molekule, ani její kvantověchemický přepis, ba ani ne ta nejlepší dnes dosažitelná mnohoelektronová vlnová funkce pro benzen. Linus Pauling byl mimo jiné geniální v tom, jak dovedl přiřadit pro chemiky snadno pochopitelné znaky jistým nekonvenčním charakteristikám některých důležitých chemických sloučenin.
Je zajímavé, jak málo je unás v úvahách o pravdivosti různých odvětví lidského poznání používán základní pojem zobrazení. Ve skutečnosti každý badatel neredukuje při vlastní výzkumné práci poznávané objekty či jevy, ale zobrazuje je na soustavu - strukturu - jistého vědního oboru. Aby toto přiřazení bylo užitečné, musí také implikovat jisté přiřaditelné funkce avztahy (relace) v jedné idruhé struktuře. V matematice je tento postup běžný a ukazuje se, že zajímavé a popřípadě užitečné relace v zobrazovaném systému (množině) a systému, na nějž se zobrazuje, mohou být často jednoznačně, jindy ale nejednoznačně vzájemně přiřazeny. Tedy opakuji, benzen není plně popsán ani konstatováním, že je to kapalina s takovými a takovými fyzikálními vlastnostmi, ani výčtem pravidel o jeho chemické reaktivitě, ani jeho chemickou formulí C6H6, ani přesnější či méně přesnou vlnovou funkcí, charakterizující stav jeho elektronů, či dokonce zároveň stav elektronů a atomových jader. A také je koneckonců jisté, že látka benzen není primitivní symbol, vypovídající orezonanci struktur podle Linuse Paulinga.
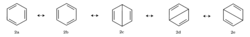 Všechny tyto popisy, užívající jisté znaky a jejich relace v příšlušné více či méně abstraktní řeči, mohou být východiskem přiřazení (překladu) vlastností a vztahů vyjádřených v jedné řeči do řeči jiné, na příklad řeči, kterou popisujeme empirii. A pochopitelně takto získané výpovědi mohou být platné pro různé vlastnosti a vztahy, leckdy pro danou řeč specifické. Často jednoduchá a lehce srozumitelná řeč - zobrazení - dává výpovědi mimořádného klíčového dosahu, které pak osvětlují chování zkoumaného objektu ve zcela novém světle, a mají tudíž základní význam pro velké oblasti lidského poznání. Paulingovy jednoduché rezonanční formule patří ktěmto důležitým výbojům lidského ducha. Dílo Linuse Paulinga by mělo být poučením nejen pro primitivně optimistické scientistické redukcionisty, ale také pro ty, kteří z nemožnosti najít - v přeneseném slova smyslu - předsokratovskou pralátku vyvozují libovolnost a neužitečnost přírodovědeckého poznání.
Všechny tyto popisy, užívající jisté znaky a jejich relace v příšlušné více či méně abstraktní řeči, mohou být východiskem přiřazení (překladu) vlastností a vztahů vyjádřených v jedné řeči do řeči jiné, na příklad řeči, kterou popisujeme empirii. A pochopitelně takto získané výpovědi mohou být platné pro různé vlastnosti a vztahy, leckdy pro danou řeč specifické. Často jednoduchá a lehce srozumitelná řeč - zobrazení - dává výpovědi mimořádného klíčového dosahu, které pak osvětlují chování zkoumaného objektu ve zcela novém světle, a mají tudíž základní význam pro velké oblasti lidského poznání. Paulingovy jednoduché rezonanční formule patří ktěmto důležitým výbojům lidského ducha. Dílo Linuse Paulinga by mělo být poučením nejen pro primitivně optimistické scientistické redukcionisty, ale také pro ty, kteří z nemožnosti najít - v přeneseném slova smyslu - předsokratovskou pralátku vyvozují libovolnost a neužitečnost přírodovědeckého poznání.