Homocystein a civilizační choroby
Homocystein je jednoduchá aminokyselina obsahující síru. Vyskytuje se v buňkách a tělesných tekutinách živých organizmů. U zdravého člověka je koncentrace homocysteinu v krevní plazmě ve srovnání s jinými aminokyselinami nízká, ale i mírné zvýšení koncentrace představuje (nezávisle na koncentraci cholesterolu) riziko srdečního a cévního onemocnění. Zjištěna byla též souvislost s dalšími závažnými chorobami. Proto je potřeba poznat význam homocysteinu v metabolizmu i v lékařské diagnostice.
Jak se homocystein stará o rovnováhu v buňce
Biochemické pochody, v nichž homocystein hraje důležitou úlohu, nejsou lidskou nebo savčí specialitou. Byly zjištěny jak v buňkách jiných živočichů, tak v buňkách rostlin a zřejmě měly význam pro rozvoj života na Zemi. Tyto pochody jsou geneticky naprogramovány a regulovány zpětnými vazbami a díky tomu se ve vnitřním prostředí živé buňky udržuje rovnováha. Buňka využívá homocystein buď opakovaně (recykluje ho), nebo ho převádí nevratně na cystein. Molekula homocysteinu je o jeden uhlík delší než molekula cysteinu a volná skupina SH je u homocysteinu reaktivnější než u cysteinu. Látky obsahující tuto skupinu (thiolátky) jsou nezbytné pro buněčné dýchání a tvorbu energie.Většina energie potřebné k životu se uvolňuje při reakci vodíku s kyslíkem za vzniku vody. Jestliže je plynná směs vodíku s kyslíkem ve zkumavce, stačí, aby přeskočila jiskra, a směs exploduje bez užitku. V buňkách se ale (díky enzymům a thiolátkám) uskutečňuje spojení protonů s kyslíkem pozvolna a řízeně. Zisk energie je stejný, ale pro buňky využitelný. Energii dovede živý organizmus uchovávat v makroergických chemických vazbách. Zásoby jsou však krátkodobé a musí se neustále doplňovat.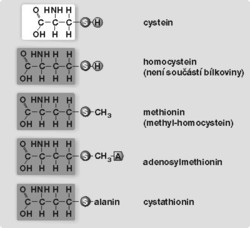
Od většiny aminokyselin se homocystein liší tím, že není součástí bílkovinných molekul, což znamená, že není přítomen v potravě. Vzniká teprve v buňkách z aminokyseliny methioninu (viz obrázek).
- Využití methioninu a recyklace homocysteinu. Methionin, ze kterého homocystein vzniká, přichází do organizmu v bílkovinách obsažených v potravě. Znovu může být využit jako stavební jednotka bílkovin, jako iniciátor jejich tvorby (proteosyntézy), nebo se může spojit s energeticky bohatým adenosintrifosfátem a vytvořit univerzální metylační koenzym 1) S-adenosylmethionin. Tato poměrně nestálá sloučenina poskytuje mnoha látkám, které jsou pro metabolizmus důležité, stavební jednotku jejich molekul metylovou skupinu. Metylací se pak výrazně mění jejich fyziologický účinek, např. z noradrenalinu se stane adrenalin (neurotransmiter neboli přenašeč vzruchů), ze serinu vznikne cholin (základní část dalšího neurotransmiteru acetylcholinu). V molekule lecitinu je cholin součástí buněčné membrány. Aminokyseliny lyzin a gama-aminomáselná se účinkem S-adenosylmethioninu přemění na karnitin, který je nezbytný pro zpracování mastných kyselin na energii. Metylací nukleových kyselin ovlivňuje S-adenosylmethionin tvorbu bílkovin a buněčné dělení (viz text a obrázek v rámečku). Jak je patrné z uvedeného přehledu, spotřeba S-adenosylmethioninu je obrovská a methionin z potravy ji nestačí krýt. S-adenosylmethionin se proto musí opakovaně tvořit z homocysteinu. Tato přeměna se uskuteční prostřednictvím kyseliny listové a vitaminu B12. Každý z nich má svůj vlastní cyklus obnovy.
Homocystein rychle vzniká a zas rychle zaniká. Buď se přemění na methionin, nebo se vydá směrem na cystein. Ve vyváženém rytmu (podle kolísání místní koncentrace protonů a kyslíku) je využíván v obou směrech. Pokud se rytmus naruší, začne se homocystein hromadit, a tím se naruší průběh všech návazných pochodů.
- Cyklus kyseliny listové (folátu). Kyselina listová působí jako lapač jednouhlíkových zbytků odštěpených z velkých molekul. Nejdřív se tato kyselina aktivuje enzymovou redukcí (naváže 4 protony). Vznikne tetrahydrofolát, který je schopen jednouhlíkový zbytek zachytit. Přímo na své molekule ho pak pozmění do podoby, kterou buňky v dané tkáni zrovna potřebují. Upravený zbytek může být dále využit, nebo vyloučen z těla ven (viz rámeček).
Kdyby zůstaly jednouhlíkové zbytky (např. formaldehyd, kyselina mravenčí, radikál metylu) volné, působily by silně toxicky.
- Cyklus vitaminu B12 (kobalaminu). Kobalamin převezme od tetrahydrofolátu metylovou skupinu, která vznikla úplnou redukcí zachyceného jednouhlíkového zbytku. Převezme ji teprve tehdy, když získá potřebné množství energie, které jej přemění na radikál (metylkobalamin). Potom již snadno předá metylovou skupinu homocysteinu, a tím jej přemění na methionin. Zároveň se kobalamin vrátí do výchozího stavu. Pokud se tak nestane, zůstane metylová skupina zakonzervována ve vazbě na tetrahydrofolát a vytvoří jeho zásoby. V krvi se folát vyskytuje téměř výhradně v této metylované formě a jeho zásobárnou jsou červené krvinky.
- Tvorba cysteinu z homocysteinu. Podobně jako methionin přichází i cystein do těla spolu s potravou a slouží také jako stavební jednotka bílkovin. Lidský organizmus však vyžaduje přesně řízenou tvorbu cysteinu z homocysteinu, a tím nepřímo z methioninu. Důkazem toho je závažné onemocnění, které je vyvoláno nedostatečnou aktivitou enzymu cystathionin-syntázy. Ten ve své molekule obsahuje vitamin B6 (pyridoxin) a aktivuje sloučení homocysteinu se serinem za vzniku cystathioninu. Jeho rozštěpením vzniknou cystein a homoserin.
Cystein má v buněčném metabolizmu široké využití. Může ovlivňovat jednak strukturu bílkovin (tvoří disulfidické můstky mezi řetězci), jednak aktivitu enzymů. V metabolických drahách poskytuje svou skupinu SH dalším látkám. Spolu s aminokyselinami glycinem a kyselinou glutamovou tvoří tripeptid glutathion. Ten představuje v buňce největší podíl z přítomných thiolátek. Je součástí redox-systému, který udržuje rovnováhu mezi reakcemi směřujícími buď k oxidaci živin, nebo k jejich redukci. Díky své schopnosti přijímat a předávat protony je nezastupitelný pro dýchací řetězec, jímž jsou protony a elektrony přenášeny řízeně k jejich konečnému příjemci kyslíku. Glutathion vrací vitaminy C, E, A a K, podílející se na redox-reakcích, do jejich aktivního stavu. Z těla také odstraňuje některé toxické látky, např. těžké kovy.
Pokud skupina SH zůstane v buňkách volná, reaguje též s molekulami kyslíku přinášenými krví. Jako volné radikály potom atomy kyslíku vstupují nekoordinovaně do enzymových reakcí, popřípadě poškozují buněčné struktury. Oxidovaná síra se nakonec vyloučí z těla jako síran. Zbytek cysteinu se prostřednictvím vitaminu B6 přemění na kyselinu glutamovou. Částečně oxidovaná molekula cysteinu nazývaná taurin je po spojení s kyselinou cholovou využita k trávení tuků jako žlučová kyselina taurocholová.
- Cyklus kyseliny citronové a purinových nukleotidů. Z molekuly cysteinu pocházejí také skupiny SH koenzymu A a kyseliny lipoové, které umožňují transport živin a odštěpování protonů, elektronů a CO2 z cukrů a mastných kyselin. Hlavním místem jejich působení je cyklus kyseliny citronové. Sem směřuje i homoserin, který vznikl ze serinu a homocysteinu prostřednictvím enzymu cystathionin syntázy. Vstoupí do cyklu kyseliny citronové právě za pomoci koenzymu A a vitaminu B12 jako jantaran koenzym A. (Zde však vitamin B12 působí v jiné molekulární formě, než v jaké se uplatňuje při tvorbě methioninu.)
Součástí koenzymu A je vedle cysteinu také vitamin skupiny B kyselina pantothenová. V cyklu kyseliny citronové se opakovaně využívají ještě další vitaminy této skupiny: thiamin, pyridoxin, biotin a bezprostřední přenašeče protonů a elektronů niacin a riboflavin.
Protony a elektrony uvolněné v cyklu kyseliny citronové jsou následně využity pro buněčné dýchání. S ním je spojena tvorba energie v cyklu purinových nukleotidů, s nímž je cyklus kyseliny citronové propojen. V jejich složitém metabolizmu je recyklován také adenosin, který se uvolnil spolu s homocysteinem. Na doplnění zásob purinových nukleotidů se podílejí, jak jsme již uvedli, jednouhlíkové zbytky vychytávané a přenášené tetrahydrofolátem. Tím se uzavírá propojení cyklů, díky němuž jsou probíhající děje u zdravého člověka koordinovány.
Ukazatel při hledání poruchy
Volné skupiny SH homocysteinu ohrožují buněčný metabolizmus tím, že snadno reagují s látkami rozpuštěnými v tělních tekutinách (včetně molekulárního kyslíku) i s molekulami na povrchu tkání. Výsledkem je nekoordinovaný vznik škodlivých volných radikálů. 2)Naproti tomu skupiny SH zabudované do větších molekul (např. kyseliny lipoové, koenzymu A či glutathionu) jsou nepostradatelné pro řízené uvolňování protonů a elektronů ze živin i pro jejich další přenos. Zopakujme, že mezi metabolickými ději, které využívají homocystein, je nezbytná rovnováha a přesný časový souběh.
Jestliže homocystein v krvi stoupne, souvisí to hlavně s jeho nedostatečnou přeměnou na methionin nebo cystein v buňkách některého orgánu. Příčinou může být nedostatek kyseliny listové nebo vitaminu B12 v potravě, jejich špatné vstřebávání, popřípadě neschopnost buněk přeměnit jednouhlíkový zbytek na metylovou skupinu a následně ji předat homocysteinu. Sem lze zařadit např. nedostatečnou aktivitu enzymu metylentetrahydrofolátreduktázy, který je odpovědný za vznik metylové skupiny. K zlepšení jeho funkce se podávají vysoké dávky kyseliny listové. Pokud porucha v transmetylaci vyvolaná místním nedostatkem S-adenosylmethioninu zasáhne nervovou tkáň, vede to k neuropatiím a demenci. Buňky srdce jsou zase citlivé na nedostatečnou tvorbu karnitinu, neboť mastné kyseliny patří mezi hlavní zdroje energie srdečního svalu. Hromadění homocysteinu může být vyvoláno také nedostatečnou aktivitou cystathioninsyntázy (v tom případě se její aktivita zvyšuje podáváním vitaminu B6).
Ať jsou poruchy, které vyvolají vzestup homocysteinu v krvi, jakéhokoliv původu, mají vždy na metabolizmus postiženého orgánu neblahé účinky. Nárůst homocysteinu v každém případě ukazuje na poruchu metabolizmu síry v buňkách postiženého orgánu. To se obrazí na sníženém výkonu cyklu kyseliny citronové, snížené spotřebě kyslíku buňkami, a tedy i snížené tvorbě energie. To může znamenat, že člověk je ohrožen cévními a srdečními chorobami, únavovým syndromem, popřípadě Parkinsonovou a Alzheimerovou chorobou.
Dirigent metabolického orchestru
Dokonce ani normální hladina homocysteinu v krvi nemusí znamenat, že je vše v pořádku. Existuje totiž enzym, který dekarboxyluje S-adenosylmethionin a umožní jeho využití pro tvorbu polyaminů potřebných pro buněčné dělení. Při zvýšené aktivitě zmíněného enzymu chybí část S-adenosylmethioninu jako zdroj homocysteinu a adenosinu. Místo toho vzniknou jiné (příbuzné) látky. Nedostatek S-adenosylmethioninu a jeho metabolitů pak naruší rovnováhu v celém systému (viz obrázek v rámečku). Zdá se, že molekula Sadenosylmethioninu, ve které se stýkají hlavní metabolické cesty (metylu, síry a energie), je jakýmsi dirigentem usilujícím o souhru zúčastněných látek. Jeho cílem je držet homocystein na uzdě.
A nemá to lehké. Rovnováhu může narušit také zvýšená oxidace cysteinu a zvýšená spotřeba živin v cyklu kyseliny citronové. Cystein přidaný ve formě léku acetylcysteinu působí příznivě pravděpodobně tím, že pomůže uvést celý systém opět do rovnováhy, tj. doplní ztráty metabolitů vyvolané oxidací a podpoří i transmetylaci.
Výsledky analýz homocysteinu při stanovení diagnózy je nutné posuzovat též ve vztahu k analýzám dalších látek, které s ním metabolicky souvisejí. Nepochybné však je, že zjištění třeba i mírné homocysteinemie může včas odhalit blížící se zdravotní krizi.
Literatura
Přistoupilová K., Přistoupil T. I.: Role of Folates in Metabolic Pathways. Academia, Praha 1997Přistoupilová K., Přistoupil T. I., Heyrovský M.: Homocystein molekula těšící se rostoucí pozornosti, Chem. Listy 93, 365–374, 1999
Přistoupilová K., Přistoupil T. I.: The Key Role of Sadeno sylmethionine and its Dissociates in General Metabolism and in Considerations on Hyperhomocysteinemia, Klin. Biochem. Metab. 8, 252–257, 2000
Poznámky
Metabolické děje, které jsou na obr. dvourozměrné, probíhají ve skutečnosti v účelně uspořádaném trojrozměrném prostoru buňky, respektive cytoskeletu. Reagující složky na povrchu enzymů se snáze vzájemně orientují a mají bezprostřední kontakt.
- Methionin a cystein přicházejí do těla z bílkovinné části potravy. Methionin získaný touto cestou nestačí krýt všechny požadavky, které tělo potřebuje. Proto se musí tvořit znovu z odpadních látek
Ke stažení
 Článek ve formátu PDF [378,08 kB]
Článek ve formátu PDF [378,08 kB]
















