Jak umírají buňky?
Posledních asi dvacet let podniká biologická věda proti tajemstvím přírody kampaně. Možná tomu tak bylo i předtím, ale toto pozorování se vymyká mé osobní zkušenosti. Zažil jsem kampaň prostaglandinovou, kdy se účinkem prostaglandinů vysvětlovalo úplně všechno, leč pak se objevily leukotrieny, lipoxiny, ...a ostrý obraz skutečnosti se zase rozmazal. V závěsu za eikosanoidy (jak se nakonec začaly výše uvedené sloučeniny souhrnně označovat) nastupovaly volné radikály. Všechno bylo způsobeno peroxidací lipidů a jediná naděje na záchranu spočívala v superoxiddismutáze. Její zkratka SOD se stala magickým zaklínadlem a autoři jejího objevu byli navrhováni na Nobelovu cenu, ale dosud ji ještě nedostali, protože se ukázalo... Svět se zkrátka zase vrátil ke své složitosti. Minulých deset let jsme s napětím sledovali růst NO (viz Vesmír 72, 255, 1993/5). Nyní se nacházíme ve stavu, kdy se grantové komise ohánějí při zamítnutí grantu tím, že projekt neobsahoval vztah dané problematiky k účinkům NO. A nejžhavější novinkou, která v průběhu dvou let začala vyvolávat novou kampaň, je apoptóza.
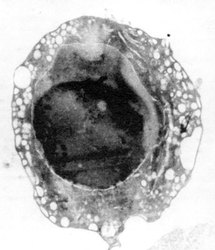 Základní charakteristikou všech kampaní bylo vždy to, že nová kampaň dokazovala svou nadřazenost nad minulými tím, že je do sebe zahrnula a prohlásila se vyšším zobecněním. To si ale zastánci starých pořádků nenechávali líbit a palbu opětovali. Jelikož jsem se už svou prací identifikoval s volnými radikálisty, pokusím se v následující stati ukázat, že apoptóza není nic jiného, nežli další z projevů aktivity volných radikálů.
Základní charakteristikou všech kampaní bylo vždy to, že nová kampaň dokazovala svou nadřazenost nad minulými tím, že je do sebe zahrnula a prohlásila se vyšším zobecněním. To si ale zastánci starých pořádků nenechávali líbit a palbu opětovali. Jelikož jsem se už svou prací identifikoval s volnými radikálisty, pokusím se v následující stati ukázat, že apoptóza není nic jiného, nežli další z projevů aktivity volných radikálů.
Podívejme se nejprve na charakteristiku činitelů spouštějících apoptózu:
- Ionizační záření (volné radikály „an sich“) – indukuje tvorbu reaktivních intermediátů redukce kyslíku (superoxid O2–, peroxid vodíku H2O2, hydroxylové radikály –OH) a navozuje u řady buněk apoptózu. Rozsah radikálového poškození určuje, jestli buňka podlehne nekróze (při vysokých dávkách), nebo apoptóze (za nižších hladin volných radikálů).
- NO – induktor apoptózy u makrofágů a monocytů. Pro nás, přesvědčené radikálisty, to není žádné překvapení, protože dobře víme, že NO představuje jen dalšího člena rodiny volných radikálů, který je mimo jiné schopen reagovat s kyslíkem za vzniku superoxidu a peroxidu vodíku.
- Léky
- Cisplatina, lipidy s éterovou vazbou, a doxorubicin (adriamycin) jsou protinádorové léky, produkující reaktivní kyslíkové intermediáty. K zániku citlivých buněk dochází apoptózou.
- Některé léky působí ve stejném duchu tím, že eliminují buněčnou obranu před volnými radikály. Např. buthioninsulfoxamin snižuje hladinu glutathionu (GSH), který je nezbytným kofaktorem obranných enzymů.
- Fyziologické regulátory – např. faktor nekrotizující tumory (TNF), který je mediátorem apoptózy, navozuje po vazbě na specifický receptor v cílových buňkách zvýšenou produkci reaktivních sloučenin kyslíku. Podobně antigen Fas, tvořící součást receptoru TNF, spustí apoptózu, jestliže se na něj naváže specifická protilátka. Tato odpověď se nevyvolá, když jsou stimulovány obranné buněčné mechanizmy proti kyslíkovým radikálům.
Jaké faktory dokážou apoptóze zabránit?
- Antioxidanty – U apoptózy spouštěné TNF se jako inhibitor prokázal N-acetylcystein, prekurzor GSH. Podobně antioxidanty WR-1065, kyselina retinová a vitamin E (nejrozšířenější přirozený antioxidant) inhibovaly apoptózu v různých buňkách.
- SOD (samozřejmě) – Rezistence k apoptóze vyvolané TNF korelovala se zvýšenou hladinou SOD v buňkách. Naopak na SOD chudé T-buňky byly snáze zahubeny účinkem TNF nebo ionizačního záření. Rovněž T-buňky infikované virem HIV, mající snížené hladiny SOD a dalších antioxidačních systémů, jsou velmi citlivé k apoptóze vyvolané oxidačním poškozením.
- Produkty některých genů – Apoptóza je regulována genem bcl-2. Má se za to, že jeho produkt, protein Bcl-2, inhibuje apoptózu tím, že interaguje s mitochondriální SOD (jak jinak). U buněk postrádajících tento faktor se apoptóze zabránilo nasazením antioxidantů. Podobně adenoviry kódovaný protein E1B, který je funkčním analogem Bcl-2, chrání napadené buňky před apoptózou.
Jakými mechanizmy reaktivní sloučeniny kyslíku spouštějí apoptózu?
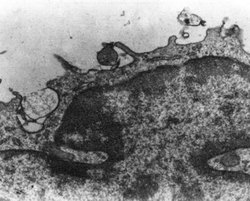
Na základě analogie s hlísticí Caenorhabditis elegans a jejími geny ced 3 a ced 4 (viz předchozí článek, Vesmír 73, 550, 1994/10) se předpokládají „geny smrti“ i u vyšších organizmů. Aktivace jejich transkripce by mohla být zprostředkována transkripčními faktory, jako je NFKB, který se v buňce objeví jako odpověď na oxidační poškození. Jedním z „genů smrti“ spouštějícím apoptózu by mohl být c-myc. Ve shodě s dosavadním výkladem je skutečnost, že protein AP-1, který byl charakterizován jako „faktor odpovídající na antioxidanty“, brání expresi genu c-myc, a tím inhibuje apoptózu. Máme tak i mechanizmus účinku antioxidantů na úrovni DNA.
Protože každá ideologie dovedená do důsledků je škodlivá zejména sama sobě, měl bych na závěr přiznat, co jsem zamlčel, abych dosáhl kýženého efektu. Tak např. některé antioxidanty jsou neúčinné při blokování apoptózy, nebo exprese genu bcl-2 zabraňuje apoptóze i u buněk postrádajících mitochondrie atd. Takže pomocí volných radikálů se bohužel nedají vysvětlit všechny taje apoptózy, nicméně doufám, že se mi podařilo ukázat, že studium volných radikálů k tomuto cíli může významně přispět.
Geny
U transgenních myší postrádajících gen pro Bcl-2, a tudíž i ochranný vliv tohoto proteinu, dochází k masivní apoptóze v ledvinách a brzlíku, zatímco CNS těchto myší se vyvíjí zcela normálně. To svědčí o existenci dalších genů, které jsou schopny inhibovat apoptózu.
Nedávno byly izolovány další dva geny: bcl-xL a bcl-xS, které do řízení apoptózy zasahují. Delší gen bcl-xL kóduje protein sestávající z 233 aminokyselin, jenž je vysoce podobný proteinu Bcl-2 a přispívá rovněž k vysoké rezistenci vůči apoptóze. Je dokonce účinnější než déle známý Bcl-2. Kratší gen kóduje protein tvořený 170 aminokyselinami a jeho působení je odlišné od působení proteinu Bcl-2. Protein Bcl-xS funguje jako dominantní induktor buněčné smrti, a dokonce zabraňuje ochrannému působení Bcl-2. Velké množství mRNA, která kóduje Bcl-xS, se nachází v nezralých thymocytech. V brzlíku při selekci T-lymfocytů hyne téměř 95 % lymfocytů, které nesplňují výběrová kritéria např. pro svou autoreaktivitu. Zvažuje se úloha Bcl-xS při neurodegenerativních onemocněních. Proteiny Bcl-x tvoří podobnou konkurenční dvojici jako proteiny Bcl-2 a Bax.
K. White se spoluautory publikoval v dubnu 1994 objev nového genu rpr, působícího programovanou buněčnou smrt u drozofily. V buňkách, které jsou určeny k zániku, lze detegovat mRNA tohoto genu již 1 2 hodiny před prvními morfologickými známkami apoptózy. Octomilky s mutací genu rpr umírají ještě před vykuklením...
Protože apoptóza hraje životně důležitou roli, je regulována a kontrolována na více úrovních. Pochopení celé regulace by umožnilo ovlivňovat průběh řady onemocnění. Poněvadž vysoce reaktivní kyslíkaté radikály mohou též vyvolat spuštění apoptózy, je možné, že tento pochod se uplatňuje při vzniku neurodegenerativních onemocnění, jako je např. Parkinsonova nemoc. Aktivace bcl-2 genu nebo jeho vpravení do nigrálních dopaminergních neuronů by zvýšilo rezistenci a přežívání těchto citlivých buněk a zamezilo jejich progresivní degeneraci. Slibnou terapii pro tuto chorobu představuje transplantace dopaminergních neuronů do striata (žíhaného tělesa v mozku) nemocných. Genové inženýrství (např. přenos genu bcl-2) by umožnilo výrazně zvýšit procento přežívajících neuronů po transplantaci. Navíc u neuronů jako postmitotických buněk odpadá obava z nadměrného nahromadění buněk, které by hrozilo u proliferujících buněk. Navozením apoptózy by bylo naopak zase možné navodit cílené odumírání neoplastických buněk. Protinádorová farmaka založená na bázi apoptózy začínají být konstruována. Přinese rozuzlení celé složité regulace apoptózy praktické výsledky?
















