Od nálevníků k rakovině
Předpokládám, že se řada čtenářů pozastaví nad podivným spojením v titulku příspěvku. A právě spojení podobného typu s sebou přináší tzv. „základní výzkum“, v tomto případě v protozoologii neboli vědě o prvocích, mezi které patří i nálevníci.
 Elisabeth Blackburnová z Kalifornské univerzity se na nálevníky podívala z nezvyklého úhlu. Nálevníci mají dva druhy jader, tzv. mikronukleus a makronukleus. Zatímco mikronukleus obsahuje klasický diploidní genom, makronukleus je u nálevníků jedinečný tím, že je vysoce polyploidní pro část genomu, avšak určité úseky genomu vůbec neobsahuje. Dělení nálevníků (v tomto případě, modelového druhu Tetrahymena termophila) předchází poměrně složité zdvojení genetického materiálu uloženého v makronukleu, které je spojeno s jedinečnou fragmentací chromozomů až na 10 milionů kousků DNA. Studiem pořadí nukleotidů v této DNA E. Blackburnová zjistila, že na každém konci molekuly se padesátkrát až sedmdesátkrát opakuje motiv TTGGGG (kde G je guanin a T thymin, dva ze čtyř stavebních kamenů DNA). To bylo zajímavé zjištění, jelikož o koncích chromozomů, tzv. telomerách, se do té doby nevědělo vůbec nic. Až téměř o deset let později přišel další průlom. Blackburnová ukázala, že připojení výše zmíněných opakujících se sekvencí ke koncům jakékoli DNA vnesené do kvasinek brání velmi efektivně jejich degradací, ačkoli kvasinky jsou známé svou schopností cizorodou DNA účinně ničit. To byl zásadní pokus, který prokázal, že zmíněné opakující se motivy, ochraňující telomery u nálevníků, jsou schopny plnit stejnou funkci i v kvasinkách. Definitivní důkaz úžasné konzervativnosti a univerzálnosti telomerických sekvencí podal Robert Moyzis z Národní laboratoře v Los Alamos, který zjistil, že opakující se telomerický motiv je u člověka TTAGGG (kde A je adenin).
Elisabeth Blackburnová z Kalifornské univerzity se na nálevníky podívala z nezvyklého úhlu. Nálevníci mají dva druhy jader, tzv. mikronukleus a makronukleus. Zatímco mikronukleus obsahuje klasický diploidní genom, makronukleus je u nálevníků jedinečný tím, že je vysoce polyploidní pro část genomu, avšak určité úseky genomu vůbec neobsahuje. Dělení nálevníků (v tomto případě, modelového druhu Tetrahymena termophila) předchází poměrně složité zdvojení genetického materiálu uloženého v makronukleu, které je spojeno s jedinečnou fragmentací chromozomů až na 10 milionů kousků DNA. Studiem pořadí nukleotidů v této DNA E. Blackburnová zjistila, že na každém konci molekuly se padesátkrát až sedmdesátkrát opakuje motiv TTGGGG (kde G je guanin a T thymin, dva ze čtyř stavebních kamenů DNA). To bylo zajímavé zjištění, jelikož o koncích chromozomů, tzv. telomerách, se do té doby nevědělo vůbec nic. Až téměř o deset let později přišel další průlom. Blackburnová ukázala, že připojení výše zmíněných opakujících se sekvencí ke koncům jakékoli DNA vnesené do kvasinek brání velmi efektivně jejich degradací, ačkoli kvasinky jsou známé svou schopností cizorodou DNA účinně ničit. To byl zásadní pokus, který prokázal, že zmíněné opakující se motivy, ochraňující telomery u nálevníků, jsou schopny plnit stejnou funkci i v kvasinkách. Definitivní důkaz úžasné konzervativnosti a univerzálnosti telomerických sekvencí podal Robert Moyzis z Národní laboratoře v Los Alamos, který zjistil, že opakující se telomerický motiv je u člověka TTAGGG (kde A je adenin).
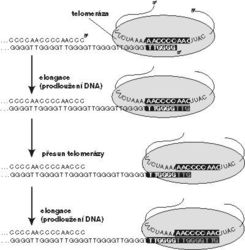
Proč jsou ale vlastně u všech dosud studovaných organizmů na koncích chromozomů tyto opakující se úseky? Je známo, že DNA-polymeráza není při zdvojování vlákna DNA schopna replikovat úplné konce původní molekuly, a chromozomy by tudíž byly vážné ohroženy zkracováním o malý kousek při každém rozdělení buňky. Jak elegantní řešení by poskytoval enzym, který by v případě potřeby konce chromozomů doplňoval! Snaha hledat takový hypotetický enzym v lidské buňce by se rovnala hledání jehly v kupce sena, pokud si představíme, že v ní je jenom 46 chromozomů s dvojnásobným počtem konců. O co lepším terénem se opět jeví nálevníci se svými miliony konců ohrožených zkracováním? A vskutku, telomeráza – jak byl příslušný enzym nazván – je zde přítomna v množství dostačujícím pro její izolaci a charakterizaci. Tento neobvyklý enzym vyžaduje pro svou funkci spolupráci s molekulou RNA, která slouží jako předloha (templát) pro dosyntetizovávané konce. Blackburnové a jejím spolupracovníkům se dokonce podařilo telomerázu u některých nálevníků pozměnit tak, že již nebyla schopna vykonávat svou funkci. Logickým důsledkem pak bylo postupné snižování počtu opakujících se telomerických sekvencí až po určitou hodnotu, která byla pro prvoka smrtelná.
 Zde se jíž dostáváme ke vztahu telomer nálevníků a rakoviny. Zatím se zřejmé nikomu nepodařilo změřit, kolik dělení může absolvovat jeden nálevník, ale v ideálních podmínkách by šlo jistě o velmi vysoké číslo. Naproti tomu je počet dělení jednotlivé savčí buňky omezený a například lidské buňky přenesené do tkáňové kultury po určitém počtu dělení hynou. V souladu s výše uvedenými fakty je teorie, podle níž je počet potenciálních dělení dané buňky určen počtem opakujících se telomerických sekvencí. Přílišné zkrácení konců chromozomů vede k neúnosnému zásahu do genetické výbavy buňky a ta poté hyne. Jak je tomu ale u rakovinných buněk? Například tzv. HeLa buňky z cervikální rakoviny Heleny Langeové jsou schopny množit se neomezeně a dodnes v tkáňových kulturách dalece přežívají svou nebohou nositelku. Za co vděčí tělo „nesmrtelnosti“? Důležitým signálem může být zjištění Harleyho a spolupracovníků z laboratoře v Cold Spring Harbor. Jejich pokusy naznačují, že telomeráza je v rakovinných buňkách aktivní, zatímco její činnost nelze prokázat ve zdravých buňkách. Potenciální inhibitory činnosti telomerázy by mohly být velmi účinnými protirakovinnými léčivy. Nezbytným předpokladem k jejich získání je však izolace proteinové složky telomerázy, která se dosud nikomu nepodařila.
Zde se jíž dostáváme ke vztahu telomer nálevníků a rakoviny. Zatím se zřejmé nikomu nepodařilo změřit, kolik dělení může absolvovat jeden nálevník, ale v ideálních podmínkách by šlo jistě o velmi vysoké číslo. Naproti tomu je počet dělení jednotlivé savčí buňky omezený a například lidské buňky přenesené do tkáňové kultury po určitém počtu dělení hynou. V souladu s výše uvedenými fakty je teorie, podle níž je počet potenciálních dělení dané buňky určen počtem opakujících se telomerických sekvencí. Přílišné zkrácení konců chromozomů vede k neúnosnému zásahu do genetické výbavy buňky a ta poté hyne. Jak je tomu ale u rakovinných buněk? Například tzv. HeLa buňky z cervikální rakoviny Heleny Langeové jsou schopny množit se neomezeně a dodnes v tkáňových kulturách dalece přežívají svou nebohou nositelku. Za co vděčí tělo „nesmrtelnosti“? Důležitým signálem může být zjištění Harleyho a spolupracovníků z laboratoře v Cold Spring Harbor. Jejich pokusy naznačují, že telomeráza je v rakovinných buňkách aktivní, zatímco její činnost nelze prokázat ve zdravých buňkách. Potenciální inhibitory činnosti telomerázy by mohly být velmi účinnými protirakovinnými léčivy. Nezbytným předpokladem k jejich získání je však izolace proteinové složky telomerázy, která se dosud nikomu nepodařila.
Zdá se, že tento zvláštní komplex proteinu a RNA se chová v dokonalé shodě s poněkud ďábelskou Dawkinsovou teorií sobeckého genu. Svou činností poskytuje telomeráza nesmrtelnost buňce, která umožnila její projev. Vysokou cenou zaplacenou za toto povolení je v konečném důsledku smrt organizmu – nositele „poblázněné“ buňky. (Science 265, 1656, 1994)
O autorovi
Julius Lukeš