Mezibuněčná hmota
Přirozené pochody téměř vždy odvisejí od částí tak malých, že se naprosto vymykají smyslům.
René Descartes
Ještě v padesátých letech byla představa o skladbě mezibuněčné hmoty velmi jednoduchá: jsou to kolagenní vlákna vnořená do základní koloidní substance. Jen některé tkáně obsahovaly ještě elastin. Dnes už známe více než 25 genových produktů kolagenů a v základní substanci celé molekulární rodiny proteoglykanů a glykoproteinů.
Organizmy nejsou pouhou sumou buněk
Obecně se přijímá, že se mezibuněčná hmota (extracelulární matrix, ECM) vyvinula jako odpověď na mechanické síly, které začaly působit uvnitř stále se zvětšujících mnohobuněčných organizmů. Podle současných představ se zdá pravděpodobnější, že primárním impulzem pro vznik molekulárně vysoce komplexní mezibuněčné hmoty byla nutnost vzájemné buněčné komunikace, zaručující souhru reakcí v mnohobuněčném organizmu.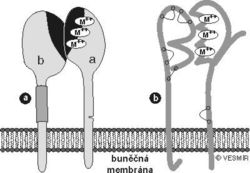 Takovou funkci splňovaly molekuly vně buněčných povrchů, které vytvářely stále složitější vzájemné vazby a zajišťovaly i mechanickou pevnost. U nejjednodušších forem obývajících vodní prostředí, které ještě nemusely čelit velkým gravitačním silám, stačila k udržení integrity základní adhezivní látka, ale už na vývojovém stupni živočišných hub došlo k vývoji složitých podpůrných struktur tvořených vlákny kolagenu, které držely architekturu organizmu pohromadě. Tato událost, k níž došlo asi před sedmi sty miliony let, umožnila vznik různorodosti tělních plánů pro jednotlivé živočišné kmeny.
Takovou funkci splňovaly molekuly vně buněčných povrchů, které vytvářely stále složitější vzájemné vazby a zajišťovaly i mechanickou pevnost. U nejjednodušších forem obývajících vodní prostředí, které ještě nemusely čelit velkým gravitačním silám, stačila k udržení integrity základní adhezivní látka, ale už na vývojovém stupni živočišných hub došlo k vývoji složitých podpůrných struktur tvořených vlákny kolagenu, které držely architekturu organizmu pohromadě. Tato událost, k níž došlo asi před sedmi sty miliony let, umožnila vznik různorodosti tělních plánů pro jednotlivé živočišné kmeny.
 Růst velikosti a pohyblivosti živočichů byl omezen malou účinností difuze při výměně látek. Další rozvoj metabolizmu si vynutil vznik prvních dopravních tras uvnitř organizmů, zpočátku sítě lakun (dutin) a později cév s nuceným oběhem. K jejich vyztužení byl použit místo kolagenu elastin, jehož pružnost odpovídala novým hydrodynamickým poměrům. Vývojově mladší formy živočichů byly schopny odolávat ještě větší mechanické zátěži. Vznikly kostry z mineralizovaného kolagenu a chrupavka tvořená kolagenní sítí vyplněnou proteoglykany a glykoproteiny.
Růst velikosti a pohyblivosti živočichů byl omezen malou účinností difuze při výměně látek. Další rozvoj metabolizmu si vynutil vznik prvních dopravních tras uvnitř organizmů, zpočátku sítě lakun (dutin) a později cév s nuceným oběhem. K jejich vyztužení byl použit místo kolagenu elastin, jehož pružnost odpovídala novým hydrodynamickým poměrům. Vývojově mladší formy živočichů byly schopny odolávat ještě větší mechanické zátěži. Vznikly kostry z mineralizovaného kolagenu a chrupavka tvořená kolagenní sítí vyplněnou proteoglykany a glykoproteiny.
Kolageny umožňují mechanickou pevnost tkání, proteoglykany jejich pružnost a adhezivní složky mezibuněčné hmoty, jako laminin, vitronektin a fibronektin, určují specifitu buněčných zakotvení v tkáni. U rostlin je nejdůležitějším mechanickým elementem mezibuněčné hmoty polysacharid celulóza. Tuhost a pružnost jednotlivých struktur je dána poměrem vláknitých i amorfních složek mezibuněčné hmoty a stupněm jejich agregace.
 Je třeba si uvědomit, že buňky představují pouze část objemu tkání a orgánů. Daleko více prostoru zaujímají adhezivní a antiadhezivní makromolekuly mezibuněčné hmoty. Chování buněk je určeno nejen zapínáním a vypínáním genové aktivity, ale také vlastnostmi mezibuněčné hmoty, přes niž je buněčná komunikace filtrována.
Je třeba si uvědomit, že buňky představují pouze část objemu tkání a orgánů. Daleko více prostoru zaujímají adhezivní a antiadhezivní makromolekuly mezibuněčné hmoty. Chování buněk je určeno nejen zapínáním a vypínáním genové aktivity, ale také vlastnostmi mezibuněčné hmoty, přes niž je buněčná komunikace filtrována.
Hlavní receptory, přes něž se buňky připojují k mezibuněčné hmotě, jsou integriny. Tvoří rozsáhlou nadrodinu nejméně 21 rozdílných heterodimerů glykoproteinové povahy, z nichž každý obsahuje nekovalentně vázanou alfa a beta podjednotku. Na základě srovnávacích studií integrinů obratlovců a bezobratlých se usuzuje, že se musely objevit ještě před rozštěpením prvoústých a druhoústých živočichů, pravděpodobně už se vznikem mnohobuněčnosti (obr. obrázek).
Úloha mezibuněčné hmoty v buněčné diferenciaci
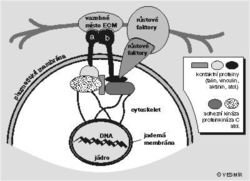
Představa, že specifické molekuly mezibuněčné hmoty dramaticky mění morfologii a funkční projevy buňky, byla potvrzena u jaterních, svalových a kožních buněk, cévní výstelky i buněk mléčné žlázy. Jako příklad uvedeme jaterní buňky zvané hepatocyty. Tyto “továrny na bílkoviny″ ztrácejí in vitro svoji formu a přestanou přepisovat geny pro albumin a cytochrom P-450. Přidáme-li však do buněčné kultury bílkoviny mezibuněčné hmoty z jejich bazální membrány, produkce albuminu i cytochromu se opět rozběhne.Podobně je určena proteiny bazální membrány (kolagen IV, laminin, fibronektin a proteoglykan) diferenciace buněk pokožky. Na povrchu buněk přiléhajícím k bazální membráně (jakési základně všech epitelů) jsou integriny vázající fibronektin mezibuněčné hmoty. Při zrání a četném dělení tyto buňky ztratí integriny i schopnost vazby na bazální membránu. Putují tedy výše a neustále doplňují ztráty nejsvrchnějších odloupaných vrstev. Přitom počnou produkovat involukrin, což je signál k produkci keratinu, změně vnitřní buněčné kostry (rohovatění) a zástavě buněčného dělení.
Obecnou hypotézu o integrační a regulační úloze mezibuněčné hmoty při buněčné diferenciaci znázorňuje obr. obrázek.
Mezibuněčná hmota při vývoji plodu
Oplozené vajíčko, jež se po pouti vejcovodem chystá uhnízdit v děložní stěně, je na rozhraní čtvrtého a pátého dne kryto tzv. zónou pelucidou, první zřetelnou strukturou tvořenou bílkovinami mezibuněčné hmoty. Tento obal vystřídá další bílkovina mezibuněčné hmoty – perlekan. Ten je rozpoznán integrinovými receptory děložní sliznice, objevujícími se výhradně mezi 19. a 24. dnem menstruačního cyklu. Takto se v děloze vytvářejí fyziologické podmínky pro přijetí plodu. Nepřítomnost integrinu u některých žen způsobuje jejich neplodnost.Po uhnízdění blastocysty začnou děložní buňky tvořit laminin a kolagen IV, tedy mezibuněčné proteiny bazálních membrán. Blastocysta proniká do děložní stěny trofoblastem, který jí umožňuje výživu. Pokud se experimentálním březím samicím místně vpraví protilátky proti těmto proteinům mezibuněčné hmoty či jejich receptorům, růst trofoblastu se zastaví. Je možné, že tohoto jevu se v blízké budoucnosti využije pro antikoncepci.
Na rozdíl od genů kódujících ostatní proteiny mezibuněčné hmoty je nepřítomnost genu pro fibronektin spojena s rozsáhlými vývojovými defekty vedoucími k smrti časného zárodku. Embrya myší, u kterých byl tento gen zničen ve stadiu blastuly, projdou ještě gastrulací, ale nevyvinou se u nich již cévy ve žloutkovém váčku, takže první krevní buňky nemohou vstoupit do oběhu. Je porušena osová organizace, chybí aorta a hřbetní struna. V desátém dni nitroděložního života embrya zanikají.
Chování nádorů je určováno mezibuněčnou hmotou
Invazivní růst nádorů je provázen nedostatkem adhezivních receptorů pro molekuly mezibuněčné hmoty na nádorových buňkách. Vazba nádorových buněk k bazální membráně je rozvolněná, což vede k jejich úniku z tkáně a přesunu na jiná místa v organizmu – metastázám. Laminin a fibronektin obsahují ve své molekule strukturu zvanou RGD (viz níže), která je pro adhezi významná. Podobně se v molekule lamininu nalézá struktura YIGSR (obě struktury jsou peptidy nazvané podle sledu aminokyselin), která se může vyskytovat i v krevním oběhu. Pokud se naváže na volné nádorové buňky, usnadňuje jejich vazbu v nových tkáních a tím se zvětšuje počet metastáz.Vazbu integrinů na molekuly mezibuněčné hmoty snižují látky zvané dezintegriny. Ty jsou obsaženy v některých hadích jedech. Dezintegriny obsahují také strukturu RGD. Pomocí ní se vážou na krevní destičky, brání vazbě fibrinogenu a fibronektinu a tím i srážení krve.
Podobný mechanizmus, tj. blokádu vazby volných nádorových buněk k molekulám mezibuněčné hmoty, by bylo možno využít ke snížení invazivnosti nádorů, a proto je terapeutické využití dezintegrinů předmětem rozsáhlého výzkumu směřujícího k praktickému využití.
Mezibuněčná hmota utváří nervový systém
Proteiny mezibuněčné hmoty jako fibronektin, některé kolageny, trombospondin a tenasciny regulují růst a orientaci nervových buněk a vláken, jejich regeneraci a tvorbu synaptických spojení. Účastní se tvorby obalů nervových vláken a vývoje podpůrných buněk. Nervové buňky jsou vybaveny integrinovými a jinými receptory, kterými interagují s molekulami mezibuněčné hmoty. V prodlužujícím se nervovém vláknu byly navíc prokázány lamininy, v nervosvalové ploténce agrin. V rozpoznávání hraje opět významnou úlohu doména RGD.Hojení ran a mezibuněčná hmota
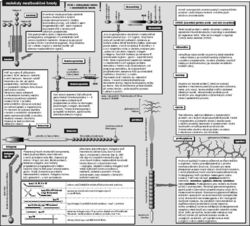
 Poškození je provázeno porušením cévních stěn a srážením krve. Krevní destičky produkují proteiny mezibuněčné hmoty (obr. obrázek). Později vcestují do rány bílé krvinky a makrofágy řídící výstavbu nové tkáně. Prozatímní tkáň se nazývá granulační podle zrnitosti patrné prostým okem, která je způsobena vrůstáním cévních pupenů. Povrch rány se překrývá novým epitelem a fibronektin granulační tkáně je postupně nahrazován kolagenními vlákny. Tkáň se stahuje a tvoří jizvu.
Poškození je provázeno porušením cévních stěn a srážením krve. Krevní destičky produkují proteiny mezibuněčné hmoty (obr. obrázek). Později vcestují do rány bílé krvinky a makrofágy řídící výstavbu nové tkáně. Prozatímní tkáň se nazývá granulační podle zrnitosti patrné prostým okem, která je způsobena vrůstáním cévních pupenů. Povrch rány se překrývá novým epitelem a fibronektin granulační tkáně je postupně nahrazován kolagenními vlákny. Tkáň se stahuje a tvoří jizvu.