Editování RNA
Jedno odpoledne roku 1984 přišel Just Brakenhoff, student molekulární biologie na Amsterdamské univerzitě, za svým vedoucím Robem Bennem a oznámil mu, že na svém autoradiogramu našel něco velmi podivného. Sekvence informační (messengerové) RNA (mRNA) jednoho mitochondriálního genu trypanozomy, neblaze proslulého původce spavé nemoci, se v krátkém úseku lišila od známé sekvence v DNA. Nikdo z nich netušil, že právě přišli na jeden ze zásadních objevů molekulární biologie 80. let.
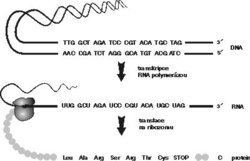
Zhruba o 23 let dříve bylo díky práci M. W. Nirenberga, S. Ochoy, H. G. Khorany a dalších vynikajících biologů odhaleno tajemství zápisu genetické informace, uložené v DNA prostřednictvím pouhých 4 písmen, nukleotidů G,C,A a T. Genomová informace je napřed přepsána do RNA, a poté prostřednictvím tripletového kódu přeložena do 20písmenového jazyka proteinů (viz tabulku).
Centrální dogma molekulární biologie
Roku 1956 formuloval Francis Crick tzv. centrální dogma „DNA kóduje RNA, RNA kóduje protein“, které se stalo úhelným kamenem molekulární biologie. Podle jeho součásti, tzv. pravidla kolinearity, jsou aminokyseliny v bílkovině uspořádány přesně v takovém pořadí, jaké lze předpovědět z pořadí nukleotidových bází v příslušném úseku DNA (obrázek). Poté, co byla platnost těchto pravidel ověřena u představitelů všech skupin živých organizmů, byla považována za nedotknutelná a jakákoli zásadnější úchylka od nich za evolučně neúnosnou. Jinými slovy se předpokládalo, že organizmus, který by se těmito pravidly neřídil, by byl v průběhu evoluce eliminován.Během posledních zhruba 15 let však byla objevena řada nejrůznějších mechanizmů, umožňujících některým organizmům tu nebo onde striktní linii centrálního dogmatu obejít nebo se i vrátit. Beze změny zůstal jedině směr od nukleových kyselin k proteinům. Nazpět, zdá se, cesta nevede (lamarkisté, co vy na to?!).
Již objev intronů a exonů, za který byla v loňském roce udělena R. J. Robertsovi a Ph. A. Sharpovi Nobelova cena, ukázal, že transkripce z DNA do RNA může být velmi komplikovaná. Poté, co je určitý úsek DNA přepsán do mRNA, dochází procesem zvaným sestřih (splicing) RNA k vyštěpení přesně určených oblastí, tzv. intronů, a následně k přesnému spojení exonů (viz schéma a Vesmír 73, 9, 1994/1). Takto upravená RNA může být na ribozomech přeložena do funkčního polypeptidového řetezce. Mechanizmus, jakým dochází ke zcela přesnému vyštěpování intronů a k následovnému spojování exonů, se v posledních letech velmi intenzivně studuje.
 Dalším zásahem do příliš zjednodušeného schématu centrálního dogmatu byl právě objev editování RNA, ke kterému došlo téměř zárověň u lidského parazita Trypanosoma brucei a u příbuzného prvoka Crithidia fasciculata, který je jako neškodný organizmus nalézán v mouchách. Oba tito prvoci jsou řazeni do řádu Kinetoplastida, jehož převážně parazitičtí zástupci se vyznačují tolika zvláštnostmi, jako málokterá skupina organizmů 1) . Jednou z nich (a podle ní získala Kinetoplastida své jméno) je přítomnost specifické buněčné struktury nazývané kinetoplast. Nejde o organelu v pravém slova smyslu, neboť kinetoplast je vlastně jen část velmi velké mitochondrie. Je lokalizován vždy u kořene bičíku a lze jej dobře pozorovat i optickým mikroskopem. Hlavní strukturou kinetoplastu je mitochondriální DNA. U většiny organizmů představuje zlomek celkové buněčné DNA, u trypanozom a příbuzných bičíkovců je však situace značně odlišná. Kinetoplastová DNA zde tvoří něco kolem 10 až 40 % buněčné DNA a je uspořádána do sítí vzájemně propojených kruhových vláken DNA dvou typů, označovaných jako maxi- a minikroužky. Podstatný úsek zhruba 50 sekvenčně totožných maxikroužků kóduje „klasické“ mitochondriální geny a tvoří menší část kinetoplastu, zatímco funkce minikroužků, kterých je asi 10 tisíc, zůstávala dlouho nejasná. Nekódují totiž žádné geny (tj. nejsou zde delší čtecí rámce) a minikroužky jsou značně sekvenčně různorodé.V tomto článku se zmíníme pouze o přepisu kinetoplastové DNA do RNA a o editaci této RNA, která s kinetoplastem úzce souvisí.
Dalším zásahem do příliš zjednodušeného schématu centrálního dogmatu byl právě objev editování RNA, ke kterému došlo téměř zárověň u lidského parazita Trypanosoma brucei a u příbuzného prvoka Crithidia fasciculata, který je jako neškodný organizmus nalézán v mouchách. Oba tito prvoci jsou řazeni do řádu Kinetoplastida, jehož převážně parazitičtí zástupci se vyznačují tolika zvláštnostmi, jako málokterá skupina organizmů 1) . Jednou z nich (a podle ní získala Kinetoplastida své jméno) je přítomnost specifické buněčné struktury nazývané kinetoplast. Nejde o organelu v pravém slova smyslu, neboť kinetoplast je vlastně jen část velmi velké mitochondrie. Je lokalizován vždy u kořene bičíku a lze jej dobře pozorovat i optickým mikroskopem. Hlavní strukturou kinetoplastu je mitochondriální DNA. U většiny organizmů představuje zlomek celkové buněčné DNA, u trypanozom a příbuzných bičíkovců je však situace značně odlišná. Kinetoplastová DNA zde tvoří něco kolem 10 až 40 % buněčné DNA a je uspořádána do sítí vzájemně propojených kruhových vláken DNA dvou typů, označovaných jako maxi- a minikroužky. Podstatný úsek zhruba 50 sekvenčně totožných maxikroužků kóduje „klasické“ mitochondriální geny a tvoří menší část kinetoplastu, zatímco funkce minikroužků, kterých je asi 10 tisíc, zůstávala dlouho nejasná. Nekódují totiž žádné geny (tj. nejsou zde delší čtecí rámce) a minikroužky jsou značně sekvenčně různorodé.V tomto článku se zmíníme pouze o přepisu kinetoplastové DNA do RNA a o editaci této RNA, která s kinetoplastem úzce souvisí.
 Vše se začalo výše zmíněným objevem čtyř uridinů (U) v mRNA genu pro mitochondriální enzym – cytochromoxidázovou podjednotku II (cox II), které nebyly kódovány v DNA. Již dříve bylo známo, že s tímto genem není něco v pořádku. Pravidlo kolinearity umožňuje na základě sekvence DNA zcela přesně předpovídat i sekvenci aminokyselin příslušného proteinu a tato predikce vedla v případě uvedeného mitochondriálního genu k překvapivému zjištění. V jedné oblasti totiž chybějí čtyři nukleotidy nezbytné pro správný překlad a tzv. čtecí rámec je zde porušen. Teprve sekvencování příslušné mRNA ukázalo, že chybějící nukleotidy jsou do sekvence vloženy dodatečně a pořadí bází je tak pozměněno (= editováno) až na úrovni RNA (obrázek). Publikace tohoto objevu v prestižním časopise Cell (Benne a kol., 46, 819-826, 1986) vzbudila zájem mnoha laboratoří a jejich intenzivní práce pak přinesla řadu zcela nečekaných výsledků. V následujích letech byly v mitochondriální DNA nalezeny další geny, jejichž transkripty jsou editovány. Příkladem může být gen pro III. podjednotku cytochromoxidázového komplexu, u jehož přepisu do mRNA prokázala skupina K. Stuarta ze Seattlu inzerci (vložení) 558 uridinů a současnou deleci (vystřižení) 40 uridinů. Důsledkem tak rozsáhlé textové úpravy je pak celková změna výsledné sekvence RNA v porovnání s odpovídajícím úsekem DNA.
Vše se začalo výše zmíněným objevem čtyř uridinů (U) v mRNA genu pro mitochondriální enzym – cytochromoxidázovou podjednotku II (cox II), které nebyly kódovány v DNA. Již dříve bylo známo, že s tímto genem není něco v pořádku. Pravidlo kolinearity umožňuje na základě sekvence DNA zcela přesně předpovídat i sekvenci aminokyselin příslušného proteinu a tato predikce vedla v případě uvedeného mitochondriálního genu k překvapivému zjištění. V jedné oblasti totiž chybějí čtyři nukleotidy nezbytné pro správný překlad a tzv. čtecí rámec je zde porušen. Teprve sekvencování příslušné mRNA ukázalo, že chybějící nukleotidy jsou do sekvence vloženy dodatečně a pořadí bází je tak pozměněno (= editováno) až na úrovni RNA (obrázek). Publikace tohoto objevu v prestižním časopise Cell (Benne a kol., 46, 819-826, 1986) vzbudila zájem mnoha laboratoří a jejich intenzivní práce pak přinesla řadu zcela nečekaných výsledků. V následujích letech byly v mitochondriální DNA nalezeny další geny, jejichž transkripty jsou editovány. Příkladem může být gen pro III. podjednotku cytochromoxidázového komplexu, u jehož přepisu do mRNA prokázala skupina K. Stuarta ze Seattlu inzerci (vložení) 558 uridinů a současnou deleci (vystřižení) 40 uridinů. Důsledkem tak rozsáhlé textové úpravy je pak celková změna výsledné sekvence RNA v porovnání s odpovídajícím úsekem DNA.
Po celou dobu se molekulární biologové nepřestávali ptát, kde se bere informace umožňující zcela bezchybné vložení, popřípadě vyjmutí stovek uridinů z nukleotidových sekvencí mRNA. Mějme totiž na paměti, že jediný nesprávně vložený nukleotid znamená porušení čtecího rámce a téměř jistě nefunkčnost syntetizovaného proteinu. V posledních letech byla objasněna i tato záhada.
Odpověď na sebe nedala čekat až tak dlouho. Při počítačovém srovnávání a vyhodnocování různých maxikroužkových sekvencí si B. Blum, pracovník laboratoře L. Simpsona na UCLA v Los Angeles, všiml nenápadných krátkých homologií mezi již editovanými transkripty některých genů a úseky tzv. nekódující oblasti maxikroužku. Výsledkem jeho práce byl objev nového typu molekul RNA, tzv. guide (vedoucích, řídících) RNA (gRNA). Jejich výzkum se zatím teprve rozvíjí, ale již dnes je zřejmá značná složitost jejich struktury a funkce.
Stručně si popišme proces editování mRNA genu pro ribozomální protein S12 u Leishmania tarentolae (horní část obrázku), zajímavého modelového bičíkovce parazitujícího u gekonů. Editování začíná na jedné straně pozměňované molekuly mRNA a pokračuje kaskádovitě ke druhému konci. Na celém procesu se podílí několik těchto gRNA a jeho průběh lze srovnat s koncertem sehraného orchestru. Part rozehrává gRNA 1, která se na mRNA zachytí prostřednictvím jakési kotvy, tj. krátké, ale přesné homologie mezi nukleotidy obou vláken. Poté se k sobě vlákna přiblíží i v dalším úseku, ale zde je již homologie silně narušena nebo v podstatě chybí. V gRNA jsou totiž oproti mRNA „navíc“ adeniny, jejichž komplementární protějšky – uridiny - zatím v mRNA chybějí.
 Nyní je však tato nedokonalá podobnost obou vláken rozpoznávána jakýmsi dosud neznámým mechanizmem, nejspíše komplexem proteinů schopných štěpit a opět spojovat vlákno mRNA. Uridiny jsou postupně vkládány do mRNA a tím se vytváří shoda sekvence obou vláken. Kuriózní je, že tyto uridiny s sebou přináší gRNA na tzv. „U-ocásku“, který je vtočen do editovaného místa a z něho jsou nukleotidy jeden po druhém ustřihávány. Editování pokračuje až do okamžiku, kdy je nastolena perfektní homologie mezi gRNA 1 a příslušným úsekem mRNA. V tuto chvíli se gRNA 1 z komplexu uvolňuje a ve směru čtení („downstream“) dochází k přichycení následující gRNA 2. Ta se svou kotvou zachytí v oblasti, která již byla předchozí „kolegyní“ upravena, a pokračuje v započatém díle. Pro editování jediného vlákna mRNA ribozomálního proteinu S12 je tedy nezbytná nejenom bezchybná souhra několika specifických gRNA, ale i celého komplexu zatím neznámých proteinů.
Nyní je však tato nedokonalá podobnost obou vláken rozpoznávána jakýmsi dosud neznámým mechanizmem, nejspíše komplexem proteinů schopných štěpit a opět spojovat vlákno mRNA. Uridiny jsou postupně vkládány do mRNA a tím se vytváří shoda sekvence obou vláken. Kuriózní je, že tyto uridiny s sebou přináší gRNA na tzv. „U-ocásku“, který je vtočen do editovaného místa a z něho jsou nukleotidy jeden po druhém ustřihávány. Editování pokračuje až do okamžiku, kdy je nastolena perfektní homologie mezi gRNA 1 a příslušným úsekem mRNA. V tuto chvíli se gRNA 1 z komplexu uvolňuje a ve směru čtení („downstream“) dochází k přichycení následující gRNA 2. Ta se svou kotvou zachytí v oblasti, která již byla předchozí „kolegyní“ upravena, a pokračuje v započatém díle. Pro editování jediného vlákna mRNA ribozomálního proteinu S12 je tedy nezbytná nejenom bezchybná souhra několika specifických gRNA, ale i celého komplexu zatím neznámých proteinů.
Teprve poznatky o editování RNA umožnily vysvětlit, proč si každá trypanozoma vydržuje masivní spletenec kruhových molekul mitochondriální (kinetoplastové) DNA. Pro úpravu transkriptů svých mitochondriálních genů totiž potřebuje desítky až stovky různých gRNA, které jsou kódovány jak v maxikroužcích, tak v minikroužcích.
Každý, kdo se věnuje studiu editování RNA, se nutně musí ptát, proč se právě u bičíkovců z řádu Kinetoplastida zachoval (či vyvinul!) tak nesmírně složitý, a tudíž také jistě značně poruchový mechanizmus dekódování genetické informace, když zřejmě absolutní většina tzv. vyšších organizmů řeší celý problém prostou transkripcí a translací, popřípadě doprovázenou sestřihem. Na tuto otázku ještě zdaleka neznáme odpověď, avšak nejnovější výsledky dávají za pravdu těm, kteří se domnívají, že editování je evolučně velice starý jev.
 Během mé práce v laboratoři Dr. R. Benneho na Amsterdamské univerzitě se nám podařilo nalézt argumenty podporující tento názor na modelu Trypanoplasma borreli, zajímavém bičíkovci také z řádu Kinetoplastida, parazitujícím v krvi ryb. Zcela nečekaný výsledek přineslo studium evolučně velmi konzervativního genu kódujícího podjednotku I cytochromoxidázového komplexu (cox I), jehož transkript není u trapanozom, leishmanií a crithidií editován, tj. jde o “normální“ mitochondriální gen (obrázek). Výsledné pořadí aminokyselin v enzymu cox I je u všech zmíněných parazitických bičíkovců prakticky shodné. Buňka trypanoplazmy k němu však dospěje zcela odlišnou, mnohem komplikovanější cestou. V části příslušné mRNA umožní totiž četné inzerce a delece uridinů „zesmysluplnění“ původní informace uložené v DNA (obrázek).
Během mé práce v laboratoři Dr. R. Benneho na Amsterdamské univerzitě se nám podařilo nalézt argumenty podporující tento názor na modelu Trypanoplasma borreli, zajímavém bičíkovci také z řádu Kinetoplastida, parazitujícím v krvi ryb. Zcela nečekaný výsledek přineslo studium evolučně velmi konzervativního genu kódujícího podjednotku I cytochromoxidázového komplexu (cox I), jehož transkript není u trapanozom, leishmanií a crithidií editován, tj. jde o “normální“ mitochondriální gen (obrázek). Výsledné pořadí aminokyselin v enzymu cox I je u všech zmíněných parazitických bičíkovců prakticky shodné. Buňka trypanoplazmy k němu však dospěje zcela odlišnou, mnohem komplikovanější cestou. V části příslušné mRNA umožní totiž četné inzerce a delece uridinů „zesmysluplnění“ původní informace uložené v DNA (obrázek).
Zkusme se zamyslet nad zajímavým hypotetickým vysvětlením zjištěných údajů, které je dnes podpořeno několika nezávisle na sobě získanými daty. Předpokládejme, že u evolučního předka obou parazitů procházela mRNA studovaného genu editováním. Poté, co se cesty vývoje trypanozomy a trypanoplazmy rozešly (podle údajů získaných analýzou jiných genů se tak stalo velice dávno, zhruba před 300 miliony lety), došlo u pravěké trypanozomy mechanizmem reverzní transkripce (tj. „zpětného“ přepisu z RNA do DNA) k přepisu již editované mRNA do DNA a editování tím bylo u potomků eliminováno. U trypanoplazmy však reverzní transkripce nenastala a potřeba editování transkriptu zůstala zachována. Toto z lidského pohledu nesmírně dlouhé období bylo zřejmě příliš krátké k tomu, aby stejný proces proběhl více než jednou, a trypanoplazma si proto uchovala mechanizmus po společném pravěkém předkovi. Za celou epochu, kdy jdou oba organizmy vlastní cestou, si však zachovaly téměř stoprocentní shodu ve výsledném pořadí aminokyselin u enzymu cox I. To ostatně není žádným překvapením, protože konzervovanost některých oblastí tohoto proteinu je vysoká i mezi evolučně tak vzdálenými tvory, jako jsou člověk, trypanozoma a kvasinka.
 Řada teoretických biologů již opustila nám dobře známou představu „světa Oparinovy proteinové polévky“ a nahrazují ji „světem RNA“, v němž ještě neexistovala DNA či proteiny. RNA tehdy mohla mít řadu funkcí, z nichž se zachovaly rudimenty v podobě např. autokatalytické aktivity RNA u nálevníka rodu Tetrahymena či u kvasinek rodů Neurospora a Saccharomyces (za její objev dostali r. 1989 Nobelovu cenu S. Altman a Američan českého původu Thomas Cech), či editování RNA u kinetoplastid. To může být zbytkem autoreparativního mechanizmu z časů, kdy replikace RNA byla poměrně nepřesným procesem a pro udržení správné genetické informace bylo pečlivé editování nezbytné. Největším problémem podobných teorií je však získávání důkazů na jejich podporu. Naše výsledky patří každopádně mezi první, které svědčí spíše pro značné stáří editování a tak v podstatě vyvracejí hypotézy o jeho nedávném vzniku.
Řada teoretických biologů již opustila nám dobře známou představu „světa Oparinovy proteinové polévky“ a nahrazují ji „světem RNA“, v němž ještě neexistovala DNA či proteiny. RNA tehdy mohla mít řadu funkcí, z nichž se zachovaly rudimenty v podobě např. autokatalytické aktivity RNA u nálevníka rodu Tetrahymena či u kvasinek rodů Neurospora a Saccharomyces (za její objev dostali r. 1989 Nobelovu cenu S. Altman a Američan českého původu Thomas Cech), či editování RNA u kinetoplastid. To může být zbytkem autoreparativního mechanizmu z časů, kdy replikace RNA byla poměrně nepřesným procesem a pro udržení správné genetické informace bylo pečlivé editování nezbytné. Největším problémem podobných teorií je však získávání důkazů na jejich podporu. Naše výsledky patří každopádně mezi první, které svědčí spíše pro značné stáří editování a tak v podstatě vyvracejí hypotézy o jeho nedávném vzniku.
Na závěr musím přiznat, že jsem se zcela záměrně držel editování RNA u trypanozom a jejich blízkých či vzdálenějších příbuzných a nezmínil jsem se o inzercích cytidinů u slizovky Physarum a guanosinu u paramyxovirů, či nukleotidových konverzí v mitochondriální mRNA obilovin apod. (obrázek a rámeček 1). Stupeň poznání dvou dosud známých případů editování RNA u člověka by již vyžadoval samostatný článek. V jednom se autoři, zabývající se studiem různých forem editování RNA, shodují – pod tento pojem jsou nyní zahrnovány mechanicky zcela odlišné procesy, které v žádném případě nemají společný evoluční původ. Přesto, že je výzkum tohoto zajímavého jevu ještě téměř v plenkách, zdá se víc než jisté, že pochopení jeho významu a filozofie bude dalším krokem k (ne)tušeným zítřkům molekulární biologie.
Poznámky
Editování RNA u různých organizmů
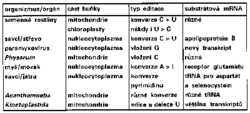 Editování RNA není výsadou jedné skupiny prvoků. Za komentář stojí i některé další případy:
Editování RNA není výsadou jedné skupiny prvoků. Za komentář stojí i některé další případy:
- V rostlinných mitochondriích a chloroplastech dochází k nahrazování C za U (někdy také U za C) v mRNA pravděpodobně mechanizmem deaminace C (aminace U). Záměny se v naprosté většině týkají cytidinů na první a druhé pozici kodonu, takže většinou bude do proteinu
vložena jiná aminokyselina, než jaká byla kódována v genu. Podobně jako u trypanozom se editováním dosáhne „správné“ sekvence aminokyselin, tak jak ji známe z proteinů třeba hub nebo savců. Často jde o velmi konzervativní místa, klíčová pro funkci enzymu. Pokud se editování zabrání, vznikají mutované, nefunkční proteiny. Editování se podobně jako u trypanozom netýká jakéhokoli C (U), ale je rozpoznáván sekvenční kontext, i když není dosud známo, v čem kontext spočívá.
- Podobně u myšího mozkového receptoru pro glutamát dochází k úpravě kodonu CAG (glutamin) na CIG (arginin). Inosin je při translaci čten jako G.
- U některých virů se vkládá do sekvence jedna nebo více bází G hned při transkripci (tzv. stuttering).
Slovníček pojmů
aminace/deaminace: obohacení/ochuzení molekuly o aminovou skupinu (NH2).
kodon: někdy nazýván i triplet. Jde o trojici nukleotidů (bází), která je kódem pro jednu aminokyselinu v bílkovině. Proteosyntetický aparát buňky čte kodony a přiřazuje podle nich příslušné aminokyseliny do syntetizovaného proteinu.
transkript: molekula RNA, která vznikla transkripcí (přepisem) z DNA.
O autorovi
Julius Lukeš
















