Symfonie evoluce
Představte si, že vám uprostřed běžného pracovního dne zazvoní telefon a neznámý volající se švédským akcentem vám oznámí, že jste získali Nobelovu cenu. Ze všedního dne se stane den jedinečný. Pro většinu z nás pouhý sen, pro Frances H. Arnoldovou reálná vzpomínka. Dvaašedesátiletá rodačka z amerického Pittsburghu dostala toto prestižní ocenění za vytrvalou práci v laboratoři, která vedla k vývoji metody řízené evoluce. Metoda přispívá k vzniku nových léků, biopaliv a ke zlepšení výroby chemických látek. O významu vědecké práce Frances H. Arnoldové (obr. 1) svědčí nejen Nobelova cena, ale také umístění v žebříčku 100 nejvlivnějších žen světa podle deníku BBC.1)
Nobelova cena za chemii udělena za evoluci ve zkumavce
Tisíce členů vědeckých akademií, univerzitních profesorů, vědců, dřívějších laureátů Nobelovy ceny a dalších osobností jsou každoročně vyzvány, aby předložily návrhy na kandidáty na Nobelovu cenu. Nominující jsou vybíráni tak, aby reprezentovali co nejvíce zemí a univerzit. Po sestavení nominací odpovídají za výběr vítězných kandidátů čtyři Nobelovy výbory.
Od roku 1901 jsou Nobelovy ceny předávány laureátům na slavnostním ceremoniálu 10. prosince při příležitosti výročí úmrtí Alfreda Nobela. Ocenění za chemii, fyziku, fyziologii, medicínu či literaturu je udělováno ve Stockholmu. Nobelova cena míru je udělována v norském Oslu, jak si to švédský vynálezce a průmyslník Alfred Nobel přál ve své poslední vůli. Slavnostní vyhlášení cen se od roku 1926 uskutečňuje ve Stockholms Konserthus. Při slavnostním předání laureáti prezentují svůj objev, popř. dílo,2) a poté jim švédský král předá diplom a medaili. Událost pokračuje na stockholmské radnici slavnostním banketem pro přibližně 1300 lidí včetně 250 studentů (obr. 2).
Předseda Nobelovy komise pro chemii Claes Gustafsson při představování letošní ceny uvedl: „Principy popsané Charlesem Darwinem použili naši laureáti ve zkumavkách k vývoji nových typů chemických látek ve prospěch lidstva.“ Frances H. Arnoldové byla udělena polovina ceny za vývoj řízené evoluce, která umožňuje vznik nových enzymů. George P. Smith a Gregory P. Winter pak sdílejí zbývající polovinu ceny za vývoj technologie zvané fágový display, jež využívá viry napadající bakterie k produkci specifických peptidů a protilátek. Obě technologie vycházejí ze stejných principů – metodami molekulární biologie vytvářejí genetické změny a následně pomocí funkčních laboratorních testů vybírají nové proteiny a peptidy.
Aktivistka, servírka, inženýrka, vědkyně a podnikatelka
Frances H. Arnoldová je dcerou Josephine Inmanové a jaderného fyzika Williama Howarda Arnolda. Vyrůstala v Pittsburghu, kde v roce 1974 absolvovala střední školu. Jako středoškolačka jela stopem do Washingtonu, D. C., aby protestovala proti válce ve Vietnamu. Na živobytí si přivydělávala jako servírka v místním jazzovém klubu a jako řidička taxi.
V Princetonu vystudovala obor strojírenství a letectví. Vedle povinných kurzů absolvovala i ekonomiku, ruštinu a italštinu. Během studia odjela na rok do Itálie, kde pracovala v továrně a cestovala. Školu dokončila v roce 1979 a v Centru pro energetiku a environmentální studia začala pracovat na problematice udržitelných zdrojů energie. Doktorát získala v oboru chemického inženýrství na Kalifornské univerzitě v Berkeley v roce 1985. Po dokončení postdoktorální stáže tamtéž a na Kalifornské technice (Caltech) se v roce 1987 stala kmenovou zaměstnankyní Caltechu a následně profesorkou v oboru chemického inženýrství.
Se svým týmem publikovala přes 350 vědeckých článků a je spoluautorkou více než 40 patentů. V roce 2005 založila společnost Gevo, která z obnovitelných zdrojů vyrábí biopaliva a chemické látky. S dvěma bývalými studenty pak založila v roce 2013 společnost Provivi zaměřenou na výzkum alternativních pesticidů pro ochranu plodin. Od roku 2016 je členkou představenstva společnosti Illumina vyvíjející nejmodernější DNA sekvenátory.
Vývoj metody řízené evoluce
Schopnost přírodních katalyzátorů – enzymů – urychlovat komplexní chemické reakce nepřestává chemiky a biochemiky fascinovat. Enzymy vyvinuté pro fungování v buňkách však často nemají vhodné vlastnosti pro praktické aplikace. Úprava jejich vlastností je logickým krokem směrem k širšímu využití enzymů v rozmanitých procesech a produktech. Arnoldová navrhla způsob, jak řídit evoluci enzymů v laboratoři pomocí procesů napodobujících přirozený výběr, původně popsaný Charlesem Darwinem. Metody laboratorní evoluce zásadním způsobem pozměnily obor proteinového inženýrství a jsou dodnes široce používány v akademických i firemních laboratořích po celém světě.
Jak řízená evoluce funguje? Metoda zahrnuje postupnou kumulaci mutací v genu proteinu v průběhu několika kol mutageneze, které jsou vždy následované výběrem užitečných variant (obr. 3). Průměrný enzym je tvořen 300 aminokyselinami. Na každé pozici se může vyskytovat jedna z 20 různých aminokyselin, což vede k astronomickému počtu 20300 variant. Pro stejně velký protein lze připravit 5700 jednobodových, 17 940 000 dvoubodových, 35 641 000 000 tříbodových variant atd. Náhodné vzorkování tak obrovského počtu mutantů není proveditelné. Arnoldová využila svých znalostí biochemie a omezila pozice, ve kterých bylo možné zavést mutace s očekávaným pozitivní vlivem na biologickou funkci. Současně se při mutagenezi vyhýbala oblastem, ve kterých by mutace mohly vést k destabilizaci proteinů.
Řízená evoluce modelového enzymu subtilisinu
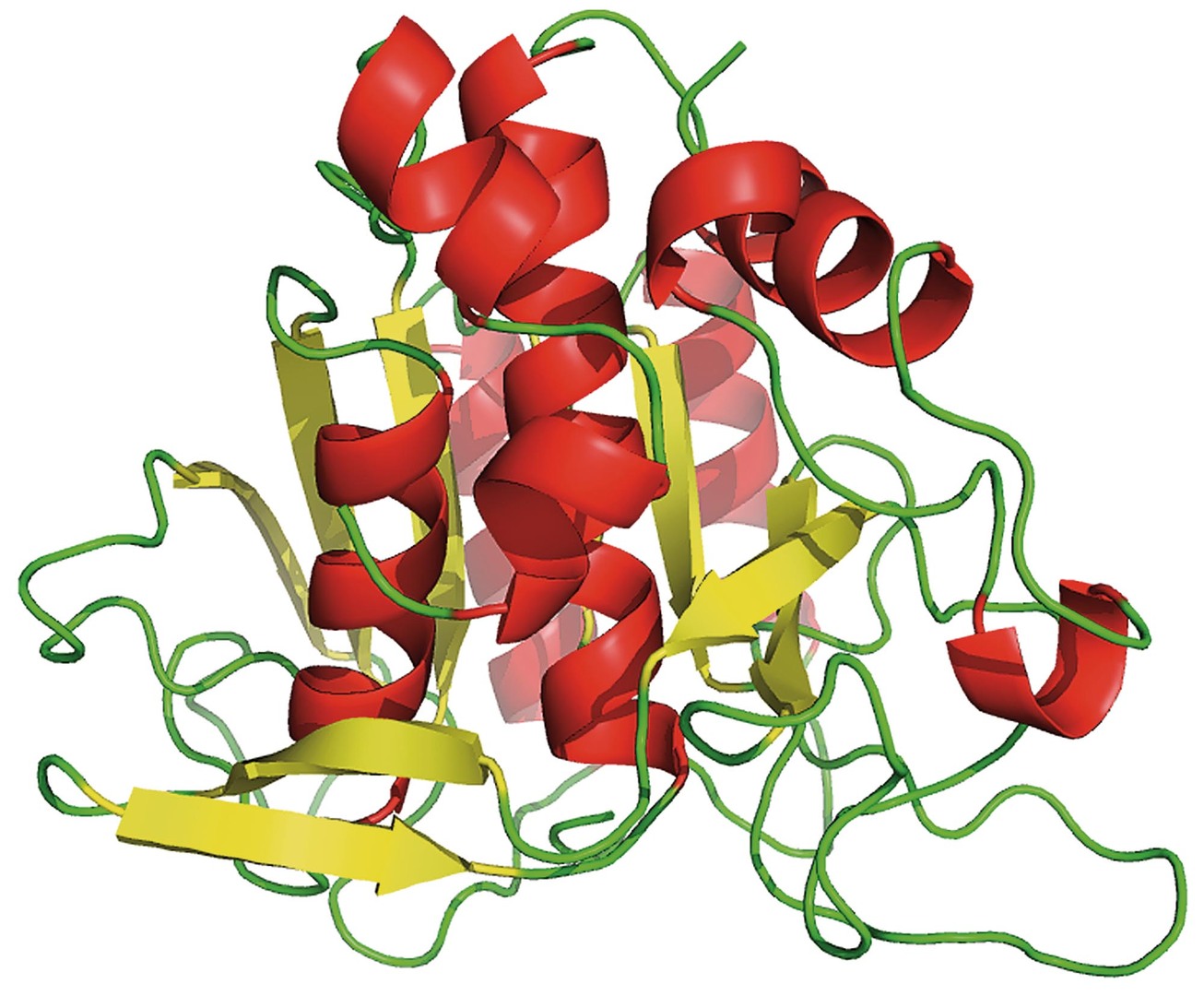
Arnoldová a její spolupracovníci použili k prvním experimentům modelový enzym subtilisin. To je proteáza nespecificky štěpící jiné proteiny. Enzym byl původně izolován z bakterie Bacillus subtilis a využívá se například v pracích prášcích k odstraňování nečistot z oděvů. Obsahuje 275 aminokyselin a je složen z několika alfa-šroubovic a centrálního skládaného listu (obr. 4). Enzym je sice stabilní v přítomnosti organických rozpouštědel, avšak vykazuje nízkou aktivitu. Tým Arnoldové se pokusil ve svých experimentech tuto aktivitu zvýšit.
Experiment zahájili přípravou sady mutantů obsahující substituce náhodných aminokyselin. Pro generování genetické diverzity použili techniku chybující polymerázové řetězové reakce, při které je gen kopírován za neoptimálních podmínek, během nichž dochází ke vzniku chyb. Mutantní geny byly transformovány do bakterií, které podle upravené genetické informace vyprodukovaly modifikované enzymy. Po každém kole mutageneze byly mutantní enzymy testovány na svou schopnost štěpit protein kasein. Varianty s vylepšenou aktivitou byly vybrány a jejich DNA byla izolována pro další kolo mutageneze. Touto cestou bylo dosaženo postupné záměny tří aminokyselin, které vedly k 40násobnému vylepšení přírodního enzymu. Dalšími šesti generacemi mutageneze se podařilo vytvořit 500krát aktivnější enzym.6)
Arnoldová vyvinula i další metody optimalizace enzymů založené na řízené evoluci. Alternativní přístup využívá DNA rekombinaci, při které jsou geny rozštěpeny na krátké úseky a opětovně spojeny, přičemž tato rekombinace je velmi účinnou metodou pro generování nové funkční rozmanitosti. Arnoldová rekombinovala geny z různých zdrojů s určitou úrovní podobnosti, čímž kumulovala příznivé mutace v takzvaných chimérních proteinech. Například řízenou evolucí enzymu para-nitrobenzyl esterázy využívající DNA rekombinaci a náhodnou mutagenezi dosáhla 470násobného zvýšení jeho aktivity.7)
Poděkování: Děkuji Dominice Damborské za cennou diskusi k obsahu článku a přípravu úvodního odstavce. Jitce Sedláčkové děkuji za jazykovou a stylistickou korekturu rukopisu.
Literatura
Podrobnější údaje o Nobelově ceně:
The Nobel Prize Award Ceremonies and Banquets. NobelPrize.org. Nobel Media AB, 2019.
Francis H. Arnold – Facts – 2018. NobelPrize.org. Nobel Media, 2018
Poznámky
1) https://www.bbc.com/news/world-46225037.
2) Nobelovská přednáška F. Arnoldové – https://www.youtube.com/watch?v=6hOZ5e0g9Uo.
3) Softwarové nástroje – https://loschmidt.chemi.muni.cz/peg/software.
4) Letní škola proteinového inženýrství – https://loschmidt.chemi.muni.cz/school.
5) Bloom J. D., Arnold F. H., PNAS, DOI: 10.1073/pnas.0901522106.
6) Arnold F. H., Chemical Engineering Science, DOI: 10.1016/S0009-2509(96)00288-6.
7) Moore J. C., Arnold F. H., Nature Biotechnology, DOI: 10.1038/nbt0496-458.
Ke stažení
 článek ve formátu pdf [404,98 kB]
článek ve formátu pdf [404,98 kB]
O autorovi
Jiří Damborský