Po naší civilizaci zbudou stopy v genomech
 Chromozomy každého vyššího organizmu se vyvíjely mnoho desítek milionů let a představují vyvážený harmonický celek, jenž zajišťuje vývoj a reprodukci organizmu. Ačkoliv na chromozomech najdeme složky, které podléhají poměrně rychlé evoluci, jako jsou mobilní sekvence DNA (Vesmír 79, 273, 2000/5), mikrosatelity (Vesmír 78, 328, 1999/6) a tandemové repetitivní sekvence, většina genomu se nemění, zůstává stálá po mnoho generací. Například chromozomy člověka a šimpanze mají obdobnou strukturu, co se týče rozložení genů, a na úrovni sekvence DNA je podobnost až 98 %. Vzniká otázka, jak bude genom propracovaný evolucí reagovat na cizorodou DNA vnesenou člověkem. Co se stane s chromozomem, který nedobrovolně získá cizí genetický element? Do jaké míry může nová genetická informace ovlivnit integritu systému harmonizovaného evolucí, popřípadě ovlivnit jeho funkci? Na úsvitu genetických manipulací se nabízely hypotetické možnosti od pasivního chování genomu vůči cizorodé DNA přes odmítnutí a „odhojení“ až po vražedné zhroucení cílového organizmu. Podívejme se nyní, jak vypadá situace dnes, po několika desítkách let zkušeností s vkládáním cizorodé DNA do genomů – nejen za účelem přípravy mediálně vděčných transgenních zemědělských plodin, ale také v rámci základního výzkumu fungování genů.
Chromozomy každého vyššího organizmu se vyvíjely mnoho desítek milionů let a představují vyvážený harmonický celek, jenž zajišťuje vývoj a reprodukci organizmu. Ačkoliv na chromozomech najdeme složky, které podléhají poměrně rychlé evoluci, jako jsou mobilní sekvence DNA (Vesmír 79, 273, 2000/5), mikrosatelity (Vesmír 78, 328, 1999/6) a tandemové repetitivní sekvence, většina genomu se nemění, zůstává stálá po mnoho generací. Například chromozomy člověka a šimpanze mají obdobnou strukturu, co se týče rozložení genů, a na úrovni sekvence DNA je podobnost až 98 %. Vzniká otázka, jak bude genom propracovaný evolucí reagovat na cizorodou DNA vnesenou člověkem. Co se stane s chromozomem, který nedobrovolně získá cizí genetický element? Do jaké míry může nová genetická informace ovlivnit integritu systému harmonizovaného evolucí, popřípadě ovlivnit jeho funkci? Na úsvitu genetických manipulací se nabízely hypotetické možnosti od pasivního chování genomu vůči cizorodé DNA přes odmítnutí a „odhojení“ až po vražedné zhroucení cílového organizmu. Podívejme se nyní, jak vypadá situace dnes, po několika desítkách let zkušeností s vkládáním cizorodé DNA do genomů – nejen za účelem přípravy mediálně vděčných transgenních zemědělských plodin, ale také v rámci základního výzkumu fungování genů.
Případ, kdy méně znamená více
Cílem genetických modifikací rostlin je pozměnit fenotyp tak, aby lépe vyhovoval požadavkům zemědělství, k nimž patří odolnost vůči škůdcům a vnějším stresům, vyšší výtěžky, vzhled či trvanlivost plodů apod. Ovlivnění těchto parametrů je podmíněno přítomností produktu genetické modifikace – bílkoviny. Ať už tuto bílkovinu chceme produkovat ve velkém nebo ji „jen“ zkoumat, máme zpravidla zájem na tom, aby byl její výtěžek co nejvyšší. To lze uskutečnit několika způsoby. Jednak tím, že před gen umístíme silný promotor, který zabezpečí intenzivní expresi genu. Jinou možností je umístit do buňky více kopií téže transgenní DNA. V bakteriích by se to dalo zařídit poměrně snadno tím, že zvolíme plazmid, který se vyskytuje v buňce v desítkách kopií jako extrachromozomální DNA. Skutečně ve světě bakterií platí, že čím více kopiemi plazmidové DNA je bakteriální buňka vybavena, tím více transgenní bílkoviny se vytváří. Zajímavé je, že při absenci selekčního tlaku (například zastavením dodávek antibiotika do kultivačního média) se počet kopií cizorodé plazmidové DNA v buňce redukuje až na nulovou úroveň. Přírodní bakterie na rozdíl od upravených bakteriálních kmenů mají zachovaný rozeznávací systém, který dokáže odlišit svoji DNA od cizorodé. Cizorodá DNA, která není správně označena metylacemi nukleotidových bází, záhy podléhá degradaci. Vidíme, že i v poměrně jednoduchém prokaryotickém světě jsou k dispozici prostředky jak se vypořádat s cizorodou genetickou informací, kterou buňka nepotřebuje, nicméně stoprocentní ochrana genomu zřejmě neexistuje. V této souvislosti se například odhaduje, že během souvislosti se například odhaduje, že během evoluce si běžná střevní bakterie Escherichia coli vyměnila genetické informace s jinými bakteriálními druhy v rozsahu odpovídajícím až 60 % jejího genomu (Vesmír 76, 655, 1997/11).
Ovlivnění těchto parametrů je podmíněno přítomností produktu genetické modifikace – bílkoviny. Ať už tuto bílkovinu chceme produkovat ve velkém nebo ji „jen“ zkoumat, máme zpravidla zájem na tom, aby byl její výtěžek co nejvyšší. To lze uskutečnit několika způsoby. Jednak tím, že před gen umístíme silný promotor, který zabezpečí intenzivní expresi genu. Jinou možností je umístit do buňky více kopií téže transgenní DNA. V bakteriích by se to dalo zařídit poměrně snadno tím, že zvolíme plazmid, který se vyskytuje v buňce v desítkách kopií jako extrachromozomální DNA. Skutečně ve světě bakterií platí, že čím více kopiemi plazmidové DNA je bakteriální buňka vybavena, tím více transgenní bílkoviny se vytváří. Zajímavé je, že při absenci selekčního tlaku (například zastavením dodávek antibiotika do kultivačního média) se počet kopií cizorodé plazmidové DNA v buňce redukuje až na nulovou úroveň. Přírodní bakterie na rozdíl od upravených bakteriálních kmenů mají zachovaný rozeznávací systém, který dokáže odlišit svoji DNA od cizorodé. Cizorodá DNA, která není správně označena metylacemi nukleotidových bází, záhy podléhá degradaci. Vidíme, že i v poměrně jednoduchém prokaryotickém světě jsou k dispozici prostředky jak se vypořádat s cizorodou genetickou informací, kterou buňka nepotřebuje, nicméně stoprocentní ochrana genomu zřejmě neexistuje. V této souvislosti se například odhaduje, že během souvislosti se například odhaduje, že během evoluce si běžná střevní bakterie Escherichia coli vyměnila genetické informace s jinými bakteriálními druhy v rozsahu odpovídajícím až 60 % jejího genomu (Vesmír 76, 655, 1997/11).
Zabývejme se nyní otázkou, jaký je osud cizorodé DNA u mnohobuněčných organizmů, kde se transgenní DNA musí integrovat do chromozomu, neboť plazmidové molekuly se, až na výjimky, v buňce samostatně neudrží. Vzhledem k tomu, že eukaryotické promotory jsou většinou slabé (nezajišťují dostatečné množství RNA), vznikla myšlenka zvýšit množství produkované bílkoviny tím, že vneseme do chromozomu nikoliv jednu, nýbrž hned několik identických kopií transgenu. Zdálo by se, že umístěním několika kopií transgenu do chromozomu máme jednou provždy vyhráno a můžeme získat modifikovaný organizmus, který bude produkovat velké množství kýžené bílkoviny po mnoho generací. Optimizmus, podložený touto na první pohled logickou úvahou, byl ale předčasný. V osmdesátých letech se v několika laboratořích uskutečnily experimenty na transgenních rostlinách, které upozornily na dosud netušenou vlastnost genomu. Místo aby exprese transgenní DNA se vzrůstajícím počtem kopií rostla, klesala – a v některých případech se přítomnost RNA vůbec nepodařilo prokázat. Naopak uměle vyvolané snížení počtu kopií expresi zvýšilo. Počet identických nebo v některých případech jen částečně identických kopií transgenu ovlivňoval expresi negativně. Šlo o umlčování genové exprese v závislosti na sekvenční homologii, tj. podobnosti DNA (ang. homology gene silencing), které bylo později nalezeno i u dalších biologických druhů včetně savců. Dnes víme, že k zahájení umlčovacího procesu je zapotřebí aktivní komunikace mezi homologními sekvencemi DNA, které se mohou vyskytovat buď alelicky (na stejných místech na chromozomu), nebo nealelicky (na různých chromozomech). Buňka jako by uměla „počítat“ geny, které se v genomu několikrát opakují.
 Fenomén umlčování genové exprese je dodnes obestřen záhadami. V některých případech si i více kopií transgenu v genomu udržuje dobrou expresi, v jiných stačí dvě kopie na to, aby se exprese kompletně inaktivovala. Jinde stačí přítomnost jediného lokusu „imperátoru“ a rázem jeho kontrole podlehnou všechny ostatní „podřízené“ lokusy. Lze vůbec nalézt podmínky pro optimální expresi a stabilitu transgenní DNA? Podívejme se nejprve, jaké má takový transgenní „lokus imperátor“ molekulární vlastnosti. Bylo zjištěno, že se v jeho DNA až nápadně často vyskytují přímá nebo obrácená opakování sekvenčních motivů a modifikované báze. Důležité je rovněž genetické okolí transgenu, tj. místo na chromozomu, kde k inzerci došlo. Vzájemná podobnost sekvencí, které se účastní umlčování, nemusí být nikterak dlouhá a v některých případech stačí již několik desítek nukleotidů. Jako největší paradox se ukazuje nutnost omezené syntézy RNA alespoň v počátečních fázích umlčování. Musí se gen nejprve projevit, aby se posléze stabilně umlčel? Je snad molekula RNA tím poslem, který zprostředkovává komunikaci mezi transgeny na dálku? Tyto otázky jsou horkým tématem současné molekulární biologie.
Fenomén umlčování genové exprese je dodnes obestřen záhadami. V některých případech si i více kopií transgenu v genomu udržuje dobrou expresi, v jiných stačí dvě kopie na to, aby se exprese kompletně inaktivovala. Jinde stačí přítomnost jediného lokusu „imperátoru“ a rázem jeho kontrole podlehnou všechny ostatní „podřízené“ lokusy. Lze vůbec nalézt podmínky pro optimální expresi a stabilitu transgenní DNA? Podívejme se nejprve, jaké má takový transgenní „lokus imperátor“ molekulární vlastnosti. Bylo zjištěno, že se v jeho DNA až nápadně často vyskytují přímá nebo obrácená opakování sekvenčních motivů a modifikované báze. Důležité je rovněž genetické okolí transgenu, tj. místo na chromozomu, kde k inzerci došlo. Vzájemná podobnost sekvencí, které se účastní umlčování, nemusí být nikterak dlouhá a v některých případech stačí již několik desítek nukleotidů. Jako největší paradox se ukazuje nutnost omezené syntézy RNA alespoň v počátečních fázích umlčování. Musí se gen nejprve projevit, aby se posléze stabilně umlčel? Je snad molekula RNA tím poslem, který zprostředkovává komunikaci mezi transgeny na dálku? Tyto otázky jsou horkým tématem současné molekulární biologie.
První důkazy o důležitosti molekul RNA při umlčování přinesla rostlinná genetika. Byla zkonstruována rostlina s transgenem, který vykazoval sekvenční homologii s virovou RNA. Po infikování virem se v kontrolní rostlině, která transgen nenesla, projevily příznaky virové infekce, zatímco v transgenní rostlině nikoliv. Přítomnost transgenu jako by rostlinu před virovou nákazou chránila. Při molekulární analýze nukleových kyselin se ukázalo, že v trasgenních rostlinách byla zvýšená degradace virových molekul RNA. Tento objev znamenal, že umlčení genové exprese mohou způsobovat nejen interakce DNA-DNA, ale i RNA-RNA. Tak bylo umlčování rozděleno na dva typy: v jednom případě transkripci genu zabrání inaktivovaný promotor, v druhém sice k transkripci dojde, avšak vznikající molekuly RNA jsou záhy specifickým mechanizmem degradovány. Dnes převládá představa, že speciální molekuly RNA jsou nějakým způsobem zahrnuty do obou typů umlčování. Praktickým důsledkem experimentů na tomto poli bylo vynalezení metod, jimiž se dá ovlivnit exprese endogenních genů. Vnesením krátkých „inteligentních“ molekul RNA do buňky totiž můžeme indukovat umlčování genu, aniž zasáhneme do jeho DNA. Tímto přístupem lze odhalit funkce neznámých genů, jejichž sekvence byly získány v rámci sekvenačních projektů a které jsou uloženy v nukleotidových databázích (Vesmír 76, 163, 1997/3).
Epigenetické mechanizmy umlčování aneb není všechno jen DNA
Podívejme se nyní, jak to vypadá s dědičností umlčeného stavu transgenní DNA. Mendelovy zákony klasické genetiky stanoví předvídatelný přenos znaků na potomstvo prostřednictvím genetické informace zakódované sledem nukleotidových bází v primární struktuře DNA. Zpočátku se zdálo, že nejjednodušším vysvětlením ztráty aktivity transgenu je hromadění mutací v transgenní DNA. Překvapivě však byly nukleotidové sekvence genu aktivního (neumlčeného) a neaktivního totožné. V čem tedy tkví rozdíl mezi aktivní a neaktivní formou transgenu? Chceme-li umlčování exprese transgenu pochopit, musíme sestoupit až na úroveň chemického složení DNA. Počátkem šedesátých let v pražském Ústavu organické chemie a biochemie Akademie věd zaníceně pracovali organičtí chemikové František Šorm a Jiří Doskočil.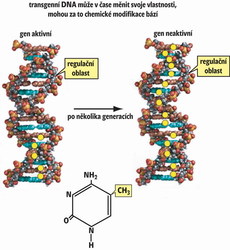 Při výzkumu protinádorových látek zjistili, že DNA živočichů a rostlin obsahuje kromě standardních nukleotidových bází adeninu, cytozinu, guaninu a tyminu ještě modifikovanou bázi metylcytozin. Dlouhou dobu se tímto poměrně málo zastoupeným nukleotidem nikdo moc nezabýval. Jak už to ve vědě bývá, některé objevy musí být téměř zapomenuty, aby pak byly znovu objeveny, a tím získaly větší slávu – viz historii Mendelových zákonů. Funkční význam modifikovaného cytozinu se začal objasňovat teprve na sklonku osmdesátých let, kdy se ukázalo, že inaktivované geny vykazují nápadně vysoký obsah metylcytozinu, zatímco jejich aktivní protějšky ho nemají vůbec nebo jen velmi málo. Jestliže se uměle vyvolal pokles obsahu metylcytozinu v DNA, pak se původně umlčený transgen znovu aktivoval. Znamenalo to, že metylcytozin na rozdíl od cytozinu nějakým dosud nevyjasněným způsobem zamezoval jeho expresi. Je třeba zdůraznit, že metylace cytozinu není omezena jen na transgeny, nýbrž že se uplatňuje v regulaci exprese mnoha důležitých genů, a dokonce se podílí na ontogenezi. Metylace DNA je tak typickým příkladem nadstavby genetické informace obsažené v DNA. Tato nadstavbová informace se nazývá epigenetická. Jako epigenetické označujeme pak dědičné, avšak převážně vratné změny v genomu. Metylace DNA nezůstává v boji s cizorodou DNA osamocena, nýbrž doplňuje další epigenetické nástroje založené na kovalentních modifikacích histonových bílkovin. Popis těchto modifikací, vztahy mezi nimi a vznik epigenetických kódů jsou již nad rámec tohoto sdělení.
Při výzkumu protinádorových látek zjistili, že DNA živočichů a rostlin obsahuje kromě standardních nukleotidových bází adeninu, cytozinu, guaninu a tyminu ještě modifikovanou bázi metylcytozin. Dlouhou dobu se tímto poměrně málo zastoupeným nukleotidem nikdo moc nezabýval. Jak už to ve vědě bývá, některé objevy musí být téměř zapomenuty, aby pak byly znovu objeveny, a tím získaly větší slávu – viz historii Mendelových zákonů. Funkční význam modifikovaného cytozinu se začal objasňovat teprve na sklonku osmdesátých let, kdy se ukázalo, že inaktivované geny vykazují nápadně vysoký obsah metylcytozinu, zatímco jejich aktivní protějšky ho nemají vůbec nebo jen velmi málo. Jestliže se uměle vyvolal pokles obsahu metylcytozinu v DNA, pak se původně umlčený transgen znovu aktivoval. Znamenalo to, že metylcytozin na rozdíl od cytozinu nějakým dosud nevyjasněným způsobem zamezoval jeho expresi. Je třeba zdůraznit, že metylace cytozinu není omezena jen na transgeny, nýbrž že se uplatňuje v regulaci exprese mnoha důležitých genů, a dokonce se podílí na ontogenezi. Metylace DNA je tak typickým příkladem nadstavby genetické informace obsažené v DNA. Tato nadstavbová informace se nazývá epigenetická. Jako epigenetické označujeme pak dědičné, avšak převážně vratné změny v genomu. Metylace DNA nezůstává v boji s cizorodou DNA osamocena, nýbrž doplňuje další epigenetické nástroje založené na kovalentních modifikacích histonových bílkovin. Popis těchto modifikací, vztahy mezi nimi a vznik epigenetických kódů jsou již nad rámec tohoto sdělení.
Osud jednoho rostlinného transgenu
V laboratoři jsme nedávno studovali stabilitu rostlinného transgenu, který jsme vnesli do genomu tabáku virginského (Nicotiana tabacum). Geneticky modifikovanou rostlinu jsme podrobili dediferenciaci a tabákové buňky jsme pak po několik generací pěstovali v buněčné kultuře nazývané kalus. Z kalusu jsme opět regenerovali rostliny – rostlinné buňky lze na rozdíl od živočišných poměrně jednoduchým způsobem podrobit dediferenciaci a zpětné diferenciaci (viz obrázek). I když byla v původní rostlině transkripce transgenní DNA velmi vysoká, ve všech pěti rostlinách, které jsme získali diferenciací z tkáňové kultury, měla nulovou úroveň. Umlčený genotyp byl stabilní i v následující generaci. Znamená to tedy, že byl transgen v průběhu generací vystaven rozpoznávacím faktorům, jejichž působení mělo za následek trvalé umlčení exprese. Abychom objasnili, proč k tomu došlo, provedli jsme rozbor struktury DNA (viz obrázek). Zjistili jsme, že epigenetické značky, metylcytoziny, se v mateřské rostlině vyskytovaly jen na konci genu v místech, kde se ukončuje syntéza RNA. Během kultivace buněk se tyto značky rozšířily po celé délce genu včetně regulačních oblastí (promotoru). To vyvolalo podezření, že značky mohou nějakým způsobem zablokovat syntézu RNA. Skutečně, když jsme pomocí chemických inhibitorů nasyntetizovaných v Ústavu organické chemie a biochemie Akademie věd tyto značky odstranili, částečně se transgen reaktivoval. Výsledek nám potvrdil hypotézu, že genom s cizorodou DNA komunikuje a podrobuje ji neustálému zkoumání. Zatím není známo, proč se některé transgeny umlčují téměř okamžitě, kdežto jiným to trvá několik generací. Víme však, že metylace DNA hraje v tomto procesu významnou roli, a zastáváme názor, že genom je neustále skenován (testován) pomocí metylačního systému. Nabízí se analogie s imunitním systémem, který vytváří nové varianty protilátek schopných rozpoznávat cizí antigeny od vlastních. Přirozenou selekcí jsou pak úseky genomu, které rostlina nepoužívá, odsouzeny k trvalému umlčení.Vznikají tak nové epigenetické varianty genů (transgenů), které nazýváme epimutace. Stabilní epimutace nevznikají jen při transgenóze, nýbrž i přirozenou cestou. Charakter epimutace má například dědičná porucha symetrie okvětních lístků lnice květelu (Linnaria vulgaris), kterou popsal C. Linné před více než 250 lety.
Poučení o stabilitě a evoluci transgenní DNA
Poučení prvé. Eukaryotická buňka nemá nástroj jak rychle eliminovat cizorodou DNA. Na rozdíl od buňky prokaryotické to totiž ani nepotřebuje. Je to proto, že se běžně nesetkává s cizorodou DNA schopnou proniknout až do jejího genomu, a také proto, že oproti buňce prokaryotické disponuje obrovským genomem, který může pohodlně přibírat další DNA, aniž to negativně ovlivní jeho funkci. Živočichové a rostliny se transgenní DNA zbavují jen velmi obtížně.
Poučení druhé. Příroda nás, mnohobuněčné tvory, obdařila prostředky, jimiž můžeme rychle a účinně zabránit expresi cizorodé DNA. Epigenetické nástroje, jako je metylace DNA, to dělají soustavně a velmi efektivně, takže se přebytečná cizorodá informace nakonec fenotypicky neprojeví.
Schopnost konzervovat a hromadit zdánlivě nepotřebné sekvence je hybnou silou evoluce eukaryotických genomů. Cizorodá informace se totiž neustále podrobuje zkoumání, může být znovu aktivována a podrobena přírodnímu výběru. Skutečně se v několika případech prokázalo, že integrovaná virová DNA poskytuje v jistých případech ochranu před invazí příbuzného viru. Některé virové sekvence, jež se před dávnými věky začlenily do genomu po úspěšném boji organizmu s virovou nákazou, evoluce natolik změnila, že se jejich produkty staly normální součástí bílkovinného spektra buňky. Zřejmě je mnohem výhodnější si cizorodou informaci podržet, molekulárně „opracovat“ a využít pro konstrukci nových genů než ji zcela odhodit. Je pravděpodobné, že podobný osud jako virové sekvence čeká i transgeny uměle vnesené člověkem. O tom, že dříve nebo později transgen mimo laboratoř nebo pole unikne a rozšíří se, nikdo (při stále intenzivnějším využívání geneticky modifikovaných organizmů) nepochybuje. Geneticky upravené plodiny, které neskončí jako naše potrava, se mohou rozšířit do okolní přírody. Je otázka, zda přítomnost transgenu poskytne rostlině ve volné přírodě selekční výhodu oproti netransgenním planě rostoucím rostlinám. Zcela jistě však mezidruhovým křížením, změnami v počtu chromozomů, stresovými vlivy a dalšími, prozatím neznámými faktory bude po čase exprese umlčena, a tím se zabrání fenotypickému vyjádření transgenu. Pokud biologický druh jako takový bude úspěšný, ještě za mnoho milionů let bude jeho DNA obsahovat zklidněnou (neaktivní) transgenní DNA. Starověcí Egypťané zanechali své stopy v podobě pyramid. Po naší civilizaci zbudou stopy v genomech. Snad jí to bude připsáno ke cti.
/Výzkum tohoto tématu podporovala Grantová agentura České republiky (521/01/0037)/
Pozn. red.: Čtenáře zajímajícího se o výzkum bezpečnosti GMO potravin odkazujeme na přehled Harryho A. Kuipera „Network Safety Assessment of Genetically Modified Food Crops, který předkládal 6. března 2003 komisi EU v Bruselu. www.entransfood.nl/meetings/entransfood%20kuiper%20March%202003.pdf
TERMINOLOGICKÝ SLOVNÍČEK (viz též Vesmír 77, 390, 1998/7)
alela – konkrétní forma genu
báze – purinová (adenin, guanin) nebo pyrimidinová (cytozin, tymin) komponenta DNA
exprese genu – převod genetické informace uložené v DNA do fenotypového znaku organizmu; u genů kódujících proteiny se uskutečňuje ve dvou stupních – transkripcí (přepisem) a translací (překladem)
fenotyp – fyzický projev dědičnosti, soubor znaků, kterými se genotyp organizmu projevuje
histony – základní bílkoviny tvořící komplexy s DNA; u eukaryont je většina DNA v komplexech
homologie – shoda v sekvenci nukleotidů nebo aminokyselin
genom – veškerá dědičná informace organizmu
genotyp – genetická konstituce organizmu představovaná souborem konkrétních alel lokus – část chromozomu, kde se nalézá příslušný gen
nukleotid – základní stavební kámen DNA složený z cukru, fosfátu a báze obrácené opakování sekvence – motivy obsahují vzájemně komplementární nukleotidy na jednom vlákně DNA, například motiv TCTG v sekvenci TCTG-CAGA
plazmid – extrachromozomální DNA schopná autonomní replikace; vyskytuje se převážně u bakterií
promotor – regulační oblast genu; obsahuje signální sekvence pro zahájení syntézy RNA přímé opakování sekvence – například motiv ACGT v sekvenci ACGT-ACGT
sekvence DNA – je dána posloupností čtyř druhů nukleotidů, např. ACTGGA
transgen – cizorodý dědičný materiál vnesený člověkem genetickou modifikací
transkripce – přepis informace z DNA do RNA; základní proces nezbytný pro fenotypické vyjádření genu
Ke stažení
 článek ve formátu pdf [280,71 kB]
článek ve formátu pdf [280,71 kB]















