Chirální molekuly na površích
 Podíváte-li se na svou tvář v zrcadle, uvidíte někoho, kdo je vám sice velmi podobný, ale jen podobný. Kdyby váš obraz vyšel ze světa za zrcadlem a postavil se vedle vás, zjistili byste řadu nesrovnalostí. Lidské tělo totiž není symetrické a každá asymetrie například v obličeji by u vašeho obrazu vyšla naopak – ať byste se vzájemně postavili jakkoliv, nikdy byste nedosáhli toho, abyste byli identičtí.
Podíváte-li se na svou tvář v zrcadle, uvidíte někoho, kdo je vám sice velmi podobný, ale jen podobný. Kdyby váš obraz vyšel ze světa za zrcadlem a postavil se vedle vás, zjistili byste řadu nesrovnalostí. Lidské tělo totiž není symetrické a každá asymetrie například v obličeji by u vašeho obrazu vyšla naopak – ať byste se vzájemně postavili jakkoliv, nikdy byste nedosáhli toho, abyste byli identičtí.
Ve skutečnosti je skoro jisté, že nepotkáte nikoho, kdo by byl vaším zrcadlovým obrazem. Naproti tomu ve světě molekul je to celkem běžné. Organické molekuly od určité velikosti mohou existovat v symetrických formách – enantiomerech – které jsou téměř identické, jedna je zrcadlovým obrazem druhé. Říkáme pak, že molekuly jsou chirální. Název pochází z řeckého slova chiros, ruka. Pravá a levá dlaň jsou zrcadlově symetrické, podobně jako tyto molekuly. Zajímavé je, jak často bývá takový poměrně malý rozdíl podstatný. Jedním z příkladů může být molekula limonenu, jejíž obě formy se vyskytují v přírodě. Jedna forma způsobuje vůni pomeranče, zatímco druhá citronu. Také aminokyseliny, základní kameny živé hmoty, se s výjimkou nejjednodušší z nich – glycinu – nacházejí v těchto chirálních formách, například aminokyselina alanin (viz obrázek). Fascinující vlastností živé hmoty je, že si pro ni příroda vybrala jen molekuly aminokyselin formy L. Proč právě L a ne D nebo třeba směs obou? Kdybychom na tuto otázku uměli odpovědět, možná bychom podstatně přispěli k osvětlení samotného základu života na Zemi.
Škodlivá a neškodná podoba
Existují ale i praktické důvody, proč se lidé zabývají chirálními molekulami. V roce 1957 byl registrován 3-ftalimidoglutarimid pod jménem thalidomid (Vesmír 75, 596, 1996/10; 79, 716, 2000/12) a s velkou slávou se prodával pod řadou jmen jako nenávyková látka s uklidňujícím účinkem. Tento lék byl také podáván budoucím matkám jako prostředek proti ranní nevolnosti, později se však ukázalo, že způsobil těžká poškození novorozenců. V roce 1960 byl stažen z trhu poté, co se zjistilo, že proti nevolnosti je účinná pouze jedna z forem (enantiomerů), zatímco druhá je odpovědná za poškození plodů. 1) Úkolem rychle a pokud možno jednoduše rozlišit formy daných molekul a tu neškodnou co nejlevněji syntetizovat se dnes zabývá řada pracovišť.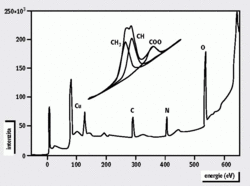 Důležitým oborem, který chirální molekuly zkoumá, je také fyzika a chemie povrchů. Povrchy pevných látek, především kovů, ale v poslední době i oxidů, se totiž používají jako katalyzátory. Zprostředkovávají reakce, samy však zůstávají po reakci nezměněny. Jako příklad lze zmínit slitiny platiny, které se montují do výfuků benzinových spalovacích motorů a na jejichž povrchu reaguje jedovatý oxid uhelnatý (CO) s kyslíkem na oxid uhličitý (CO2). I u chirálních molekul by bylo užitečné, kdyby katalyzátory umožnily získat zvolenou formu. V současné době se spíš syntetizuje směs (tedy dvojnásobné množství produktu), a pak se žádoucí forma separuje. Katalytickou reakcí, při které by byl přímo produkován zvolený enantiomer, by se výrazně ušetřilo. Kromě toho je interakce molekul na površích látek významná tím, že částice prachu nebo povrchy minerálů pravděpodobně sloužily jako podklad pro první organické reakce na zeměkouli.
Důležitým oborem, který chirální molekuly zkoumá, je také fyzika a chemie povrchů. Povrchy pevných látek, především kovů, ale v poslední době i oxidů, se totiž používají jako katalyzátory. Zprostředkovávají reakce, samy však zůstávají po reakci nezměněny. Jako příklad lze zmínit slitiny platiny, které se montují do výfuků benzinových spalovacích motorů a na jejichž povrchu reaguje jedovatý oxid uhelnatý (CO) s kyslíkem na oxid uhličitý (CO2). I u chirálních molekul by bylo užitečné, kdyby katalyzátory umožnily získat zvolenou formu. V současné době se spíš syntetizuje směs (tedy dvojnásobné množství produktu), a pak se žádoucí forma separuje. Katalytickou reakcí, při které by byl přímo produkován zvolený enantiomer, by se výrazně ušetřilo. Kromě toho je interakce molekul na površích látek významná tím, že částice prachu nebo povrchy minerálů pravděpodobně sloužily jako podklad pro první organické reakce na zeměkouli.
Stáčení polarizační roviny světla
Klasickou metodou měření chirálních molekul je stáčení polarizační roviny světla. Tento jev objevil Louis Pasteur v roce 1847. Jestliže lineárně polarizované světlo prochází prostředím, v němž převládá jeden enantiomer (může to být jak krystal, tak roztok), otočí se polarizační roviny o úhel, který závisí na množství a druhu daných asymetrických molekul. Tento jev vysvětlil později J. H. van’t Hoff, který lineárně polarizovanou světelnou vlnu vyjádřil jako součet dvou opačně polarizovaných kruhových vln – pravotočivé a levotočivé. Tyto vlny se v důsledku asymetrie prostředí šíří poněkud odlišnými rychlostmi, a když se po průchodu opět složí, změní se polarizační úhel. Na povrchu pevné látky však tuto metodu nelze jednoduše uplatnit. Informace z jedné nebo několika molekulárních vrstev může být snadno překryta informací z hlubších vrstev substrátu. Dalším problémem je, že při reflexním uspořádání projde paprsek tenkou vrstvou dvakrát, před odrazem a po odrazu na substrátu. A při každém z těchto průchodů se polarizační rovina otočí o stejně velký, ale opačně orientovaný úhel, a nakonec je výchylka nulová.Fotoelektronová spektroskopie
Jednou z metod, která se pro povrchové systémy nabízí, je fotoelektronová spektroskopie, někdy označovaná jako ESCA (Electron Spectroscopy for Chemical Analysis). Vzorek se ozáří ultrafialovým nebo měkkým rentgenovým zářením a v důsledku toho se z něj uvolňují elektrony, jejichž energetické rozdělení vykazuje strukturu ostrých maxim. Poloha každého takového maxima se dá téměř vždy jednoznačně přiřadit určitému prvku. Je-li rozlišovací schopnost měřicího systému dostatečně vysoká, dají se pozorovat atomy v různých chemických stavech a koordinacích (viz obrázek). V analogii s van’t Hoffovou interpretací Pasteurových experimentů se zde navíc nabízí možnost rozšířit tradiční fotoemisi tím, že je budicí rentgenové záření kruhově polarizované.2 Fotoemisní spektrum (viz detail obrázek) se pak snímá pro pravotočivou a levotočivou polarizaci a měří se rozdíl mezi velikostí jednotlivých maxim. Dichroizmus, tedy obrácení znaménka této změny pro oba enantiomery, byl pozorován jak v plynné fázi, tak za určitých podmínek i u adsorbovaných molekul alaninu D a L. Jeho hodnota je však malá, maximálně 5 %.Z uvedeného vyplývá, že enantiomery D a L mají poněkud odlišný účinný průřez pro fotoionizaci kruhově polarizovaným rentgenovým zářením. Mohli bychom proto spekulovat, že náklonnost živé přírody k L-formám aminokyselin by se mohla dát vysvětlit tím, že záření z vesmíru bylo v určitém stadiu elipticky polarizované, a fotochemické procesy proto dávají přednost jen jedné symetrii. Existují skutečně studie, které ukazují, že se polarizace elektromagnetického záření z kosmu systematicky otáčí. Odpověď na otázku, proč se otáčí, ale už pravděpodobně přesahuje rámec fyziky povrchů.
Literatura
U. Hergenhahn et al., J. Chem. Physics 120, 4553, 2004M. Polčík et al., Phys. Rev. Lett. 92, 236103, 2004
B. Nodland et al., Phys. Rev. Lett. 78, 3043–3046, 1997
Poznámky
Ke stažení
 článek ve formátu pdf [140,49 kB]
článek ve formátu pdf [140,49 kB]















