Cytoskelet - dynamická síť
Co způsobuje buněčný a vnitrobuněčný pohyb? Tuto otázku si kladli biologové již začátkem 19. století, ale odpověď tehdy nenašli, protože neměli k dispozici odpovídající mikroskopickou techniku. Pomocí jednoduchého světelného mikrosko pu se brzy zjistilo, že eukaryontní buňky obsahují jádro a buněčné organely, např. mitochondrie, vakuoly a chloroplasty. Hmota, v níž jsou všechna tělíska uložena, byla nazvána cytoplazma a dlouho se soudilo, že je polotekutá a nemá žádnou strukturu ani barvu. Ještě počátkem 20. století byla považována za koloidní roztok a od něj se odvozovaly všechny její vlastnosti. Teprve v druhé polovině 20. století v ní byly objeveny vláknité struktury (v návaznosti na rozvoj elektronové mikroskopie a nových fixačních i preparačních technik). Zpočátku se nevědělo, zda jde jen o artefakty vzniklé fixací, či zda to jsou skutečné struktury živých buněk. Rozvoj imunofluorescenčních metod však přinesl další nezvratné důkazy o existenci těchto vláken a koncem sedmdesátých let již bylo známo, že cytoplazmu eukaryontních buněk prostupuje hustá síť - cytoskelet. Byly rozlišeny tři typy vláken: mikrotubuly, mikrofilamenta a střední filamenta. 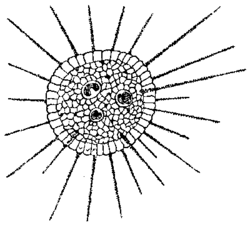
 Zpětně pak byly k cytoskeletu přiřazeny i bičíky, řasinky, mitotické vřeténko, myofibrily svalových buněk ad. Vlákna cytoskeletu byla postupně nalezena ve všech buňkách živočichů, rostlin i hub - tedy v každé buňce všech eukaryontních organizmů. Ukázalo se také, že právě cytoskeletální 1) vlákna jsou ony dlouho hledané struktury odpovídající za buněčný a vnitrobuněčný pohyb.
Zpětně pak byly k cytoskeletu přiřazeny i bičíky, řasinky, mitotické vřeténko, myofibrily svalových buněk ad. Vlákna cytoskeletu byla postupně nalezena ve všech buňkách živočichů, rostlin i hub - tedy v každé buňce všech eukaryontních organizmů. Ukázalo se také, že právě cytoskeletální 1) vlákna jsou ony dlouho hledané struktury odpovídající za buněčný a vnitrobuněčný pohyb.
Cytoskelet je proměnlivá síť
Ještě před třiceti lety většina biologů ani nevěděla, že cytoskelet existuje, nyní však je cytoskeletální princip funkční organizace buňky obecně přijímán a v každé současné učebnici buněčné biologie najdete obsáhlou kapitolu o cytoskeletálních proteinech a strukturách. Mikrotubuly a mikrofilamenta mají mnoho společných rysů. Jejich základní stavební proteiny jsou globulární a vysoce fylogeneticky konzervativní. 2) Základní stavební proteiny středních filament jsou vláknité a liší se podle typu buňky nebo jejího tkáňového původu. Na rozdíl od mikrotubulů a mikrofilament nebyla střední filamenta dosud spolehlivě prokázána u rostlin. Množství cytoskeletálních proteinů v buňce je značné, dohromady tvoří až 40 % všech buněčných bílkovin.I když název cytoskelet vzbuzuje představu pevné a neměnné struktury, jde o vysoce dynamický systém. Charakteristickým rysem jeho základních stavebních proteinů je schopnost rychle polymerovat do vláken, která mohou být stejně rychle depolymerována. Cytoskelet se proto jeví jako proměnlivá cytoplazmatická síť, která obklopuje ostatní buněčné struktury. Určuje nejen tvar a pružnost buňky, ale také umístění organel. Odpovídá za všechny druhy buněčného i vnitrobuněčného pohybu, např. za putování chromozomů během mitózy, pohyb organel, bičíků a řasinek, svalový stah nebo pohyb celé buňky. Cytoskeletální proteiny se účastní i přenosu signálů a buněčného metabolizmu. Všechny tyto základní funkce jsou pak určující pro procesy morfogeneze, buněčného dělení a schopnost komunikace buněk mezi sebou i s okolím. Cytoskelet tak funguje v buňce jako jeden z nejvyšších organizačních systémů. Jeho jedinečnost spočívá v tom, že pouze tato buněčná struktura je v kontaktu se všemi dalšími buněčnými organelami od jádra po buněčnou membránu, a proto má možnost zprostředkovávat dorozumívání mezi jednotlivými buněčnými složkami. 3) 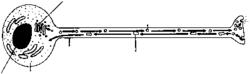
Mikrotubuly podléhají neustálým změnám
Polymery globulárního proteinu tubulinu tvoří válcovité struktury - mikrotubuly. Vnější průměr válce měří kolem 24 nm a jeho stěna se skládá ze 13 lineárních protofilament. Jejich základní stavební jednotkou je heterodimer z α-tubulinu a β-tubulinu, který podmiňuje polární strukturu. U mikrotubulů můžeme rozlišit tzv. (+) konec, na němž polymerace probíhá rychleji, a (-) konec, na němž je přidávání volných podjednotek tubulinu pomalejší. Proto mikrotubuly rostou od (-) konce k (+) konci. V buňce začíná polymerace tubulinu v místech označovaných jako organizační centra mikrotubulů, 4) která jsou u živočišných buněk shodná s oblastí centrozomu poblíž jádra. Odtud pak vyrůstají stovky jednotlivých mikrotubulů, rozbíhají se do všech stran, směřují k periferii a dosahují až k plazmatické membráně. V oblasti organizačních center byl prokázán další z rodiny tubulinů, γ-tubulin, který nepolymeruje do mikrotubulů, ale je součástí proteinového komplexu odpovídajícího za jejich „nukleaci“ - spoluurčuje místo, z nějž mikrotubuly vyrůstají.
V živočišných buňkách, jimiž jsou např. fibroblasty (viz barevné obrázky pod článkem), je vždy část tubulinu přítomna jako polymer a část je solubilní v cytoplazmě. To umožňuje rychlou přestavbu mikrotubulární sítě podle okamžitých potřeb buňky. Mikrotubuly podléhají neustálým změnám, což se projevuje tím, že se při depolymeraci zkracují a při polymeraci prodlužují. Tento jev se nazývá dynamická nestabilita mikrotubulů. Energetickým zdrojem polymerace je hydrolýza guanozintrifosfátu (GTP) vázaného na β-tubulin. Rychlost polymerace a depolymerace mikrotubulů je značná. Mikrotubuly narostou za minutu asi o 1 m, a pokud depolymerují, mohou se za minutu zkrátit až o 7 m. Cytoplazmatické mikrotubuly buněk, například fibroblastů, citlivě reagují na změnu teploty. Jestliže buňky tkáňových kultur ochladíme na 4 °C, dojde ke kolapsu mikrotubulární sítě - mikrotubuly depolymerují. Když takto ovlivněné buňky opět zahřejeme na 37 °C, můžeme již za několik minut pozorovat mikrotubuly vyrůstající z organizačních center a za 20 minut se mikrotubulární síť obnoví úplně.
Na stavbě mikrotubulů se kromě tubulinu podílejí asociované proteiny, 5) které mají funkce nejen strukturální, ale i další. Propojují mikrotubuly mezi sebou nebo s mikrofilamenty a středními filamenty, zajišťují interakce s buněčnými organelami i s plazmatickou membránou a ovlivňují rychlost polymerace mikrotubulů. Transport membránových váčků a organel podél mikrotubulů zajišťují mikrotubulární motory. 6) Sem patří kineziny a dyneiny, které mají jak vazebné místo pro tubulin, tak i schopnost vázat se na povrch membrán. Membránový váček se prostřednictvím kinezinu napojí na vlákno mikrotubulu a molekuly kinezinu ho podél něj „vezou“ od centra k buněčné periferii, tj. od (-) konce k (+) konci mikrotubulu. Dyneiny odpovídají za transport v opačném směru - z periferie buňky do jejího středu, tj. od (+) konce k (-) konci mikrotubulů. Mikrotubuly lze ve zkumavce připravit z izolovaného tubulinu. Jestliže se k takto uměle vyrobeným vláknům přidají plastové kuličky, které jsou obaleny kinezinem a mají velikost srovnatelnou s buněčnými organelami, a dodá-li se jako energetický zdroj adenozintrifosfát (ATP), můžeme v mikroskopu sledovat kuličky pohybující se podél mikrotubulů.
Vedle dynamických cytoplazmatických mikrotubulů tvoří mikrotubuly i poměrně stabilní specializované struktury, například centrioly, mitotická vřeténka v dělících se buňkách a různé druhy řasinek i bičíků, umožňujících pohyb např. prvokům či spermiím. Také výběžky neuronů můžeme považovat za zvláštní strukturu, na níž se podílejí především mikrotubuly. Neuronální tkáň je ze všech živočišných tkání nejbohatší na tubulin, protože axony i dendrity neuronů jsou plné mikrotubulárních svazků. Po mikrotubulech zde probíhá transport nového materiálu (proteinů, membrán, synaptických měchýřků ad.) z oblasti jejich syntézy v těle buňky na synaptický konec výběžku. V opačném směru jsou zase přepravovány např. „staré“ membrány, které degradují v lyzozomech v těle buňky. Tento transport, který v případě axonů překonává i délku několika metrů, umožňují výše zmíněné buněčné motory.
Mikrofilamenta
Mikrofilamenta, označovaná též jako aktinová vlákna, jsou polymery globulárního proteinu aktinu a jejich základní struktura je jako u mikrotubulů stejná u všech živočichů, hub i rostlin. Tvoří ji dvouvláknová šroubovice o průměru kolem 7 nm. Ve srovnání s mikrotubuly jsou však aktinová vlákna tenčí a ohebnější. Stejně jako tubulin se i aktin nachází v buňce ve dvou formách - polymerní (F-aktin) a monomerní (G-aktin). Aktinová vlákna také podléhají neustálému zkracování a prodlužování a jsou rovněž jako mikrotubuly polarizována - na (+) konci rostou rychleji než na (-) konci. Energie potřebná pro polymeraci aktinu do mikrofilament se čerpá z hydrolýzy ATP vázaného na monomer aktinu. Podobný význam, jako mají centrozomy pro mikrotubuly, představují pro „nukleaci“ mikrofilament určité oblasti cytoplazmatické membrány, jimiž jsou například adhezní plaky 7) nebo vedoucí lamela 8) pohybující se buňky. Kromě aktinu jsou mikrofilamenta tvořena množstvím asociovaných proteinů, které mají různé funkce. Velkou skupinou jsou proteiny určující délku aktinových vláken, z nichž některé svou vazbou na monomer zabraňují jeho polymeraci, jiné naopak polymerovaný aktin štěpí a další polymerovaný aktin stabilizují. Rozsáhlou skupinu představují proteiny odpovídající za spojování mikrofilament. Podle způsobu propojení vznikají buď svazky, nebo prostorové sítě. Ze svazků mikrofilament často vznikají krátké prstovité výběžky na membránách, zatímco sítě podpírají plazmatickou membránu. Jiné proteiny, například spektrin, vinkulin, α-aktinin, dystrofin a mnohé další, zajišťují interakci mikrofilament s plazmatickou membránou. Umožňuje ji protein včleněný do membrány spolu s kaskádou asociovaných proteinů. Podobně jako u mikrotubulů dochází i podél mikrofilament k transportu váčků a membrán, který zajišťují „buněčné motory“ asociované s mikrofilamenty. Jsou jimi proteiny z rodiny myozinů. Myoziny skládají s aktinem stažitelné svazky pro buněčnou adhezi, mezibuněčné spoje a tok cytoplazmy. Podílejí se na cytokinezi 9) a na buněčné polaritě. Ve specializované svalové tkáni, kde aktin představuje až 10 % všech buněčných proteinů, vzniká z aktinových vláken ve spojení s myozinem stabilní aparát, který využívá k svalové kontrakci energii vázanou v ATP.
Střední filamenta
Střední (intermediární) filamenta tvoří relativně stabilní síť z vláken o průměru 10 nm. Na rozdíl od mikrotubulů a mikrofilament nejsou tvořena jedním proteinem, ale mnoha základními stavebními bílkovinami. Podle podobnosti v řazení aminokyselin a tkáňovém rozšíření se dělí do několika skupin.U vyšších obratlovců je přítomnost proteinů středních filament charakteristická pro určitou tkáň nebo buněčný typ. Keratiny jsou stavebními proteiny středních filament všech epitelů. 10) Do další skupiny patří vimentin, který je charakteristický pro buňky mezenchymálního původu. 11) Desmin ve svalových buňkách spojuje myofibrily 12) do svazků a dalším je kyselý gliální fibrilární protein (GFAP), který je zastoupen v gliích. 13) Samostatnou skupinu tvoří proteiny neurofilamentového tripletu, které se spolu s mikrotubuly podílejí na stavbě axonů, 14) a skupina laminů, jež se podílejí na stavbě jaderné membrány. Přes odlišnost stavebních bílkovin je struktura všech středních filament podobná. To umožňuje skutečnost, že proteiny všech těchto skupin mají obdobnou středovou oblast, v níž se otáčejí kolem sebe. Výsledná struktura připomíná lano. Od mikrotubulů a mikrofilament se střední filamenta liší tím, že se na ně nevážou nukleotidy, pro svoji stavbu potřebují mnohem méně energie a jsou také méně dynamická. V buňkách tkáňových kultur jsou střední filamenta vimentinového typu umístěna velmi podobně jako mikrotubuly, které jejich lokalizaci určují. Jestliže jsou mikrotubuly depolymerovány chladem nebo přestavěny v důsledku působení některé antimikrotubulární látky, síť středních filament se zbortí k jádru.
Střední filamenta dávají buňkám a tkáním mechanickou podporu a pružnost, podílejí se také na mezibuněčných kontaktech (desmozomy) a na kontaktech buněk s mezibuněčnou hmotou (hemidesmozomy). Na rozdíl od mikrotubulů a aktinových vláken se zřejmě neúčastní žádné formy pohybu. Mají mnoho asociovaných proteinů, které zajišťují jejich vazbu na mikrotubuly a na membránu. Nebyly však pro ně nalezeny buněčné motory podobné kinezinům, dyneinům či myozinům. Specializovaná epiteliální tkáň obsahuje až 10krát více proteinů středních filament (keratinů) než tubulinu a aktinu. Rozvinutá síť středních filament zajišťuje mechanickou odolnost povrchu buňky. Keratiny také tvoří základ vlasů, nehtů a vlny, které jsou vlastně zbytky odumřelých epiteliálních buněk plných pevných keratinových vláken.
Perspektivy
Dá se předpokládat, že další nové poznatky o interakcích cytoskeletálních proteinů s proteiny jiných buněčných součástí zásadně přispějí k pochopení funkční buněčné organizace. V posledních letech jsou zjišťovány stále nové poznatky o účasti všech tří cytoskeletálních systémů při přenosu vnitrobuněčných signálů. Intenzivní výzkum vede k identifikaci stále nových členů proteinové rodiny kinezinů i dyneinů a zdá se, že každá organela má svůj vlastní mikrotubulární motor.U mnoha onemocnění bylo prokázáno, že jejich podstatou nebo průvodními jevy jsou defekty v cytoskeletálních proteinech. U neurodegenerativních onemocnění (např. u Alzheimerovy a Parkinsonovy choroby) to jsou změny v proteinech sdružených s mikrotubuly a v proteinech neurofilamentového tripletu, svalovou dystrofii provázejí změny v proteinu sdruženém s aktinem, při ciliární aplázii se projevuje defekt v dyneinu a u některých kožních onemocnění změny v keratinech. Čím více poznatků o cytoskeletu a mechanizmech vedoucích k jeho poškození se podaří získat, tím větší budou šance na možnost úspěšného léčení těchto nemocí. 16)
Poznámky
Citát
François Jacob: Hra s možnostmi esej o různosti života, Karolinum, Praha 1999
Čím více se nějaká oblast vědy dotýká lidských záležitostí, tím spíše se mohou platné teorie dostat do konfliktu s tradicemi a vírami. Tím více jsou také poznatky, jež věda přináší, manipulovány a zneužívány k ideologickým a politickým cílům. To se právě teď děje s biologií, kde dnes znovu vzplál starý spor o poměr vrozeného a získaného podílu u některých schopností lidských bytostí. U jednoduchých organismů je chování naprosto striktně určeno v genech. U složitějších organismů se genetický program stává méně závazným, podle výrazu Ernsta Mayra více „otevřeným“, a to v tom smyslu, že nepředpisuje do podrobností různé formy chování, ale nechává organismu možnost výběru. Dává mu určitou svobodu reakce. Místo co by mu vnucoval pevné směrnice, svěřuje organismu možnosti a schopnosti. Toto otevření genetického programu se během evoluce zvyšuje a dosahuje vrcholu u člověka. Čtyřicet šest chromozomů poskytuje lidské bytosti celou řadu schopností fyzických i duševních, z nichž může těžit a rozvíjet je nejrůznějším způsobem podle prostředí a podle společnosti, ve které vyrůstá a žije. Je to například genetická výbava, která poskytuje dítěti schopnost mluvit. Ale záleží na jeho prostředí, aby se naučilo určitý jazyk spíše než jiný. Jako každý jiný rys, i chování lidské bytosti je utvářeno v neustálé interakci genů a prostředí.
V Ústavu molekulární genetiky AV ČR se cytoskelet studuje od počátku 80. let. Vědecké práce z tohoto pracoviště přispěly k pochopení heterogenity tubulinu, orientaci tubulinových podjednotek v mikrotubulech a funkci některých proteinů asociovaných s mikrotubuly. Podařilo se zde připravit první monoklonální protilátky proti gtubulinu. Odtud pocházejí i monoklonální protilátky proti proteinům středních filament a neuron-specifickému tubulinu, které se rutinně používají při diagnostice nádorů.
Cytoskelet v léčbě a diagnostice
Některé poznatky získané při studiu cytoskeletu se již běžně užívají v lékařství.
- Při léčbě nádorových onemocnění se široce aplikují mikrotubulární inhibitory. Jsou to látky, které svou vazbou na tubulin ovlivňují stavbu mikrotubulární sítě. Mezi nejznámější patří kolchicin, který depolymeruje mikrotubuly, nebo vinblastin, který vede k vytvoření tzv. parakrystalů. Při nízkých koncentracích jsou tyto látky schopné zablokovat buněčné dělení. V ovlivněných buňkách zůstávají mikrotubuly nezměněny, jejich dynamika je však zablokována. Buňky proto nemají funkční aparát pro rozdělení chromozomů do dceřiných buněk a cyklus buněčného dělení se zastaví na začátku mitózy. U rychle se dělících buněk, jimiž jsou buňky nádorové, pak takové látky mohou zpomalit nebo úplně zastavit jejich růst. Bylo popsáno již několik desítek mikrotubulárních inhibitorů, nejčastěji se izolují z rostlin nebo jsou to jejich deriváty. Jedním z posledních objevených mikrotubulárních inhibitorů je taxol, 15) alkaloid ze západoamerického tisu (Taxus brevifolia). Taxol stabilizuje mikrotubuly a způsobuje přestavbu mikrotubulární sítě. Při nízké koncentraci také zablokuje buněčné dělení a je velmi účinný především při léčbě rakoviny vaječníků a prsu. V současné době se vyrábí synteticky (Paclitaxel) a zároveň se připravují a testují další látky (taxoidy), jejichž struktura je od něj odvozena s cílem najít léčiva i pro jiné typy nádorů.
- Při diagnostice nádorů pomáhají protilátky proti jednotlivým proteinům středních filament, a to zvláště v případech, kdy je nutné rozhodnout, jaký má nádor původ. Nádorové buňky často ztrácejí svůj normální vzhled, a proto podle vzhledu nemohou být určeny spolehlivě. Typ středních filament nalezených v buňkách nádoru však odpovídá jeho původu (epiteliální, mezenchymální nebo neuronální). Stejně je možné využít pro diagnostiku i další cytoskeletální proteiny, které se vyskytují pouze v určitých tkáních, např. určité izotypy tubulinu jsou charakteristické pro neuronální tkáň. Včasné a správné rozpoznání původu nádoru umožní vybrat správný léčebný postup, který je předpokladem úspěšné léčby.
Imunofluorescence
Imunofluorescenční techniky, které umožňují lokalizaci proteinů v rámci jedné buňky či tkáně, jsou založeny na spojení fluorescenčních látek se specifickými protilátkami. Fluorescenční látky absorbují světlo určité vlnové délky a emitují jinou, vyšší vlnovou délku světla. Jestliže jsou tyto látky osvětleny jejich absorbční vlnovou délkou a prohlíženy přes filtr propouštějící pouze světlo o emitované vlnové délce, lze na tmavém pozadí pozorovat svícení. Specifické protilátky se vážou pouze na určitý protein, proti kterému vznikly. Navázáním fluorescenční látky na protilátku tak vzniká sonda, která označí pouze sledovaný protein. K prohlížení fluorescenčních preparátů se používá fluorescenční mikroskop, který je na rozdíl od normálního světelného mikroskopu vybaven ještě silným zdrojem světla a vhodnou soustavou filtrů. Existuje velké množství fluorescenčních látek s emisí v různé části spektra. Toho využívají metody několikanásobných imunofluorescenčních značení, při nichž jsou současně sledovány dva či více proteinů a k jejichž detekci jsou použity různě barevné fluorescenční látky. Tyto metody pak dávají představu o umístění sledovaných proteinů.
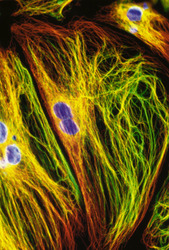
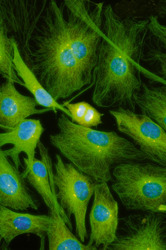
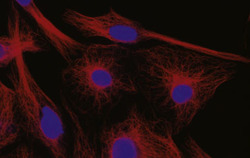
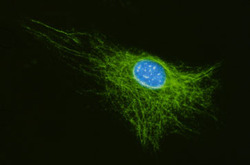
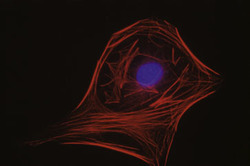
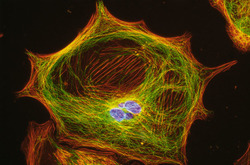
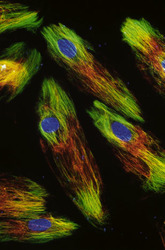
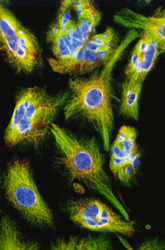
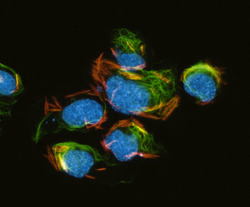
Cytoskelet ve fluorescenci
Cytoskeletální síť a jádra živočišných buněk tkáňových kultur (buněčná linie embryonálních fibroblastů 3T3 a Leydigovy buňky izolované z myších varlat) lze zobrazit s využitím několikanásobného fluorescenčního značení. K detekci mikrotubulů byly použity protilátky proti tubulinu, k detekci středních filament protilátky proti vimentinu. Pro zobrazení mikrofilament posloužil značený faloidin - látka izolovaná z muchomůrky zelené (Amanita phalloides), který se váže na polymerovaný aktin. Jádra byla barvena fluorochromem, jenž se váže výhradně na DNA.
Ke stažení
 DATA A SOUVISLOSTI - Cytoskelet [5,57 MB]
DATA A SOUVISLOSTI - Cytoskelet [5,57 MB]