Regenerace srdečních buněk
 Mnozí to známe z vlastní zkušenosti. Když se řízneme do svalů na bříšku palce nebo si při sportu poraníme svaly na končetinách, většinou se nic tak strašného nestane. Po odeznění akutní bolestivé fáze se nám začnou poškozené svaly hojit a rána se zacelí téměř bez následků.
Mnozí to známe z vlastní zkušenosti. Když se řízneme do svalů na bříšku palce nebo si při sportu poraníme svaly na končetinách, většinou se nic tak strašného nestane. Po odeznění akutní bolestivé fáze se nám začnou poškozené svaly hojit a rána se zacelí téměř bez následků.
Jiné je to se svalovinou srdeční. Jakmile je poškozena, nejčastěji nedokrevností při infarktu, růžové srdeční buňky (kardiocyty) odumírají a na jejich místě se pomnožují (proliferují) bledé fibroblasty, které zalátají postiženou oblast jizevnatou, poměrně tenkou kolagenovou tkání. To není dobré. Nejenže se kolagen nestahuje, ale ani nemůže přenášet elektrické impulzy. Od této chvíle se poškozená oblast stává překážkou pro povely ke stahu, které se musí v srdci šířit podle přesného paradigmatu. Hrozí arytmie a další oběhové potíže.
V čem spočívá problém regenerace srdečních buněk? Stručně řečeno, nemají kádrové rezervy – satelitní buňky. Nadto je jejich vlastní schopnost pomnožovat se omezena jen na časné fáze ontogenetického vývoje. Když se vyvíjejí kosterní svaly, jejich mnohojaderná, dlouhá svalová vlákna vznikají fúzí (splýváním) myoblastů. Myoblasty jsou krátké jednojaderné buňky s částečně vyvinutým kontraktilním systémem. Od r. 1961 se ví, že řada těchto malých myoblastů se s ostatními nespojí a zůstávají mimo tloustnoucí svalové vlákno; nicméně s ním jsou v těsném kontaktu pod společným vnějším obalem (bazální membránou). Dostávají nové jméno – satelitní buňky. Co je podstatné, jejich jádra i tělíčka si uchovávají jedinečnou schopnost dělení. Tuto schopnost ovšem nepoužívají, jsou-li v pořádku svalová vlákna, na jejichž „zádech“ satelity sedí.
Při poškození – a to může způsobit i neúměrná námaha – se svalová vlákna (stejně jako kardiocyty) nemohou sama opravit. Žádné z jejich vlastních jader, kterých jsou po fúzi myoblastů uvnitř stovky až tisíce (např. u vlákének kuřecích prsíček, která se při nedělním obědě tak pěkně oddělují), není už schopno dělení, protože se nacházejí v postmitotické fázi. 1) V tomto okamžiku ale nastupují do akce (myo)satelitní buňky. Téměř zároveň se zánikem poškozeného svalového vlákna se začínají dělit a splývají do nového svalového vlákna. Sval regeneruje. Je zajímavé, že se opět některé nespojí s ostatními a stanou se z nich satelity nového vlákna. Tak se regenerace svalu může opakovat i několikrát, je-li to nutné. V sedmdesátých letech jsme v laboratoři prof. E. Gutmanna ve Fyziologickém ústavu AV ČR často pozorovali dokonalou a opakovanou regeneraci svalu, který byl předtím rozetřen na jemnou kašičku nebo zničen dnes již zastaralým lokálním anestetikem markainem.
Satelitní buňky, malý zázrak…
Takovému typu funkčně vybavených a k dělení připravených buněk nějakého orgánu či tkáně říkáme buňky progenitorové. Na rozdíl od nediferencovaných a nesčíslněkrát se dělících buněk kmenových (např. krvetvorných buněk v kostní dřeni) se progenitorové buňky dělí omezeně. U svalu je to kolem patnácti dělení, což ovšem na průměrnou dobu našeho nynějšího života naprosto stačí. Progenitorové satelitní buňky jsou poměrně univerzální a při regeneraci vytvářejí zprvu jakýsi obecný prototyp svalového vlákna. Teprve pod vlivem nervů prorůstajících do místa regenerace se nová vlákna „specializují“ buď na skupiny vláken rychlých bílých (ta jsou snadno unavitelná), nebo pomalejších červených (jsou plná myoglobinu a zajišťují vytrvalostní výkony a postoje těla).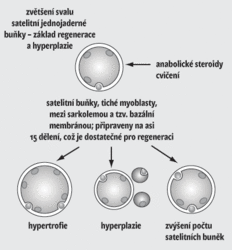 Satelitní buňky ale nejsou jen pasivními čekateli na nejhorší katastrofu – zničení svaloviny. Jsou připraveny svižně reagovat i na zvýšené nároky při fyziologické zátěži, intenzivní či opakované svalové práci a přispívat k tréninkovým výsledkům silových sportovců. Při rostoucím průměru trénovaných svalových vláken (hypertrofii) je totiž nutno zvyšovat počet jader, aby se bioenergetika namáhaného vlákna udržovala na optimální úrovni. Vlastní jádra vláken se dělit nemohou, a proto jim při hypertrofii předávají svá jádra právě přilehlé myosatelitní buňky.
Satelitní buňky ale nejsou jen pasivními čekateli na nejhorší katastrofu – zničení svaloviny. Jsou připraveny svižně reagovat i na zvýšené nároky při fyziologické zátěži, intenzivní či opakované svalové práci a přispívat k tréninkovým výsledkům silových sportovců. Při rostoucím průměru trénovaných svalových vláken (hypertrofii) je totiž nutno zvyšovat počet jader, aby se bioenergetika namáhaného vlákna udržovala na optimální úrovni. Vlastní jádra vláken se dělit nemohou, a proto jim při hypertrofii předávají svá jádra právě přilehlé myosatelitní buňky.
Při jiném typu intenzivního tréninku se počet vláken zvyšuje, a to právě týmž procesem splývání satelitních buněk. V tomto případě narůstá svalová hmota zmnožením vláken – hyperplazií (viz obrázek).
Nabízí se otázka: Není to zbytečný luxus, jestliže se běžné a často jaksi postradatelné kosterní svaly opravují docela dobře, kdežto životně nepostradatelné srdce se hojí špatně? Dosud jsme věřili, že srdeční buňky v dospělosti neregenerují, protože nemají satelitní buňky. Nebyly ani v blízkosti srdeční svaloviny prokázány nějaké buňky kmenové, které by se mohly v místě infarktu pomnožit, jakmile se tam jen trochu obnoví prokrvení a zásobování kyslíkem. Poté, co padlo dogma, že mozková tkáň neregeneruje (regeneruje, např. v hipokampu), se daly nějaké novinky čekat i v otázce reparace srdce. (Viz M. Aschermann, Vesmír 84, 320, 2005/6.)
Překvapení, o němž se zmíníme, umožnily stále se zlepšující detekční (a téměř detektivní) metody pro vypátrání i velmi malého počtu nějakého typu buněk. Máte-li dnes k dispozici nějaký znak, který je pro určité buňky charakteristický, můžete je oddělit od ostatních, které ho nemají. A přesně podle tohoto principu objevila skupina deseti badatelů vedená Kennethem Chienem v srdcích laboratorních myší, potkanů a člověka nevelká množství buněk-kardioblastů, které nesou značky (markery) pro progenitorové linie. Hledali v srdci buňky nesoucí jako identifikační znamení gen islet-1, 2) který je typický pro vyvíjející se embryonální srdeční buňky. Po narození buněk s tímto identifikačním znakem rychle ubývalo. Přesto bylo možné zbylé z nich nejen detegovat fluorescenčními barvičkami a promyšlenou kolokalizací s jinými geny (např. použitím tamoxifen-citlivých receptorů pro estrogeny), ale také je úspěšně bez poškození oddělit pomocí přístroje.
 Nezralé kardioblasty byly touto metodou nalezeny v podstatě ve všech funkčních částech srdce. V síních tvořily nevelké shluky, kdežto v komorách se vyskytovaly převážně jen jako ojedinělé buňky. A kolik jich vlastně badatelé našli? Podle Christine L. Mummeryové 3) jde např. u krysího srdce jen o velmi malý počet (nějakých pět či šest set) kardioblastů, které se zachovaly jako „relikt“ po nitroděložním vývoji srdce. To jistě není mnoho ve srovnání se satelitními buňkami kosterních vláken, které jsou ve svalu vlastně všude. Důležitější než počet kardioblastů je ale skutečnost, že jejich poměrný výskyt v jednotlivých částech srdce zůstává téměř stejný jak u laboratorních hlodavců, tak v srdci lidského novorozence, což umožňuje s jistou opatrností aplikovat poznatky z laboratoře na lidské poměry.
Nezralé kardioblasty byly touto metodou nalezeny v podstatě ve všech funkčních částech srdce. V síních tvořily nevelké shluky, kdežto v komorách se vyskytovaly převážně jen jako ojedinělé buňky. A kolik jich vlastně badatelé našli? Podle Christine L. Mummeryové 3) jde např. u krysího srdce jen o velmi malý počet (nějakých pět či šest set) kardioblastů, které se zachovaly jako „relikt“ po nitroděložním vývoji srdce. To jistě není mnoho ve srovnání se satelitními buňkami kosterních vláken, které jsou ve svalu vlastně všude. Důležitější než počet kardioblastů je ale skutečnost, že jejich poměrný výskyt v jednotlivých částech srdce zůstává téměř stejný jak u laboratorních hlodavců, tak v srdci lidského novorozence, což umožňuje s jistou opatrností aplikovat poznatky z laboratoře na lidské poměry.
Důležité otázky
Položme ale autorům studie otázky závažnější, než je ta o množství kardioblastů.Jaká je regenerační potence těchto buněk vystopovaných s takovou námahou? Zachovaly si zbylé kardioblasty svou původní schopnost dělit se a nabývat vlastností funkčních srdečních buněk, schopnost zastoupit zničenou tkáň? Lze s nimi počítat pro nápravu „zlomených srdcí“?
Odpověď na první otázky dávají autoři až překvapivě jasnou. Izolované kardioblasty pěstovali v tkáňových kulturách buď samostatně, nebo spolu s mezenchymálními podpůrnými srdečními buňkami, popřípadě s dospělými kardiocyty. Tím napodobili dvě důležité fáze vývoje skutečného srdce: fázi proliferace (množení) a fázi diferenciace (vyzrávání). Výsledky byly povzbudivé. Zpočátku se v přítomnosti mezenchymálních buněk kardioblasty jen dělily. Z několika set jich vznikly během necelého týdne miliony. Když dělení ustalo, začaly se v přítomnosti dospělých srdečních buněk diferencovat. Postupně vytvářely kontraktilní bílkoviny (např. aktinin a srdeční troponin T). V jejich membránách se objevily funkční vápníkové kanály, tak typické pro elektrickou aktivitu srdečních buněk. Také průběh jejich akčních potenciálů byl velmi podobný dozrálým kardiocytům. Buňky se začaly rytmicky stahovat, což je zase charakteristické pro spontánně bijící srdeční svalovinu. Krátce řečeno, autoři prokázali celou baterií metod elektrofyziologických, histochemických, fluorescenčních a kontrakčních (vždyť jich taky na to bylo deset), že kardioblasty skutečně dozrály na plnohodnotné kardiocyty. Ty se dokonce i navzájem propojily elektricky vodivými konexonovými kanálky (skulinovými spojeními, „gap junctions“), jak se sluší a patří na srdeční svalovinu hodnou toho jména.
Obě první otázky byly tedy odpovězeny kladně a to zakládá optimizmus i pokud jde o tu třetí, týkající se praktického využití. Věřme, že v budoucnu se podaří tyto nečetné, leč schopné progenitorové buňky z nemocného srdce izolovat. Po namnožení v tkáňových kulturách by je mohli kardiologové zpětně transplantovat do ohrožené či postižené oblasti srdečního svalu, podobně jako se to již v jistých případech provádí v mozku. Nebudou se tak léčit jen postinfarktové stavy, ale jistě i řada dalších kardiomyopatií, ať již vyvolaných infekcemi, vysokým krevním tlakem (hypertenzí) nebo jiným poškozením, např. volnými radikály.
Vedoucí týmu dr. K. Chien se ale vyjadřuje velmi opatrně a v tom mu můžeme – i když neradi – dát za pravdu. Říká, že doba pro skutečné léčebné využití těchto buněk je ještě velmi vzdálená, „možná to bude trvat dlouhá léta“. Nerozřešených otázek zůstává totiž stále ještě mnoho. Tak například kolik progenitorových buněk použitelných pro regeneraci je přítomno v srdcích starších osob, které jsou poškozením srdce ohroženy nejvíce? Budou progenitorové buňky z dospělých srdcí schopny nahradit nejen stažitelné kardiocyty, ale i vlákna srdečního převodního systému a léčit tak různé typy arytmií? Nahradí se jimi také poškozené buňky udávající základní rytmus stahů („pacemakerové“), jsou-li postiženy infarktem? Ale kdoví, třebas spolu s Kennethem Chienem máme špatný odhad a cesta mezi jeho, popř. jinými kardiologickými laboratořemi, kde se studují srdeční regenerace, a pacienty na nejbližším kardiologickém oddělení nebude zas tak dlouhá. Zatím jsme kdesi v první zatáčce, odkud je vidět cíl jen velmi nezřetelně…
Poznámky
Ke stažení
 článek ve formátu pdf [410,16 kB]
článek ve formátu pdf [410,16 kB]
O autorovi
František Vyskočil


























